常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是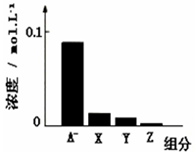
| A.HA为强酸 |
| B.该混合液pH=7 |
| C.图中X表示HA,Y表示OH-,Z表示H+ |
| D.该混合溶液中:c(A-)+ c(Y)=c(Na+) |
等体积的pH=12的碱溶液甲和pH=11的碱溶液乙,分别用等浓度的盐酸中和时,消耗盐酸的体积为2V甲=V乙。下列判断合理的是
| A.乙一定是弱碱 | B.甲一定是强碱 |
| C.乙一定是二元碱 | D.甲一定是一元碱 |
常温下,取0.3 mol/L HY溶液与0.3 mol/L NaOH溶液等体积混合(不计混合后溶液体积变化),测得混合溶液的pH=9,则下列说法(或关系式)正确的是
| A.混合溶液中由水电离出来的c(OH-)=1×10-9 mol/L |
| B.混合溶液中离子浓度大小次序为:c(Y-)>c(Na+)>c(OH-)>c(H+) |
| C.c(OH-)-c(HY)=c(H+)=1×10-9 mol/L |
| D.c(Na+)=c(Y-)+c(HY)="0.3" mol/L |
下列对溶液叙述正确的是
| A.向冰醋酸中加水至配成醋酸稀溶液的过程中H+的浓度逐渐减小 |
| B.对于物质的量浓度相同的氢氧化钠和氨水,加水稀释至m倍和n倍后,若稀释后溶液的PH相等,则m<n |
| C.在中和滴定实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,须经干燥或润洗后方可使用 |
| D.25 ℃时NH4Cl溶液的Kw大于100 ℃时NaCl溶液的Kw |
用0.01mol·L-1 NaOH 溶液完全中和pH=3的下列溶液各100mL。需NaOH溶液体积最大的是
| A.盐酸 | B.硫酸 | C.高氯酸 | D.醋酸 |
下列说法正确的是
| A.水的电离方程式:H2O = H++ OH- |
| B.pH=7的溶液一定是中性溶液 |
| C.升高温度,水的电离程度增大 |
| D.将稀醋酸加水稀释时,c(H+)减小,c(OH-)也减小 |
常温下pH为2的盐酸,下列叙述正确的是
| A.该溶液中盐酸电离出的c(H+)与水电离出的c(H+)之比为1010∶1 |
| B.向该溶液中加入等体积pH为12的氨水恰好完全中和 |
| C.将10 mL该溶液稀释至100 mL后,pH小于3 |
| D.该溶液中由水电离出的c(H+)水×c(OH-)水=1×10-14 |
已知醋酸、醋酸根离子在溶液中存在下列平衡:
| CH3COOH+H2O |
C H3COO-+H3O+ |
K1=1.75×10-5 mol·L-1 |
| CH3COO-+H2O |
CH3COOH+OH- |
K2=5.71×10-10 mol·L-1 |


 现将 50 mL 0.2 mol·L-1醋酸与 50 mL 0.2 mol·L-1醋酸钠溶液混合制得溶液甲,下列叙述正确的是
现将 50 mL 0.2 mol·L-1醋酸与 50 mL 0.2 mol·L-1醋酸钠溶液混合制得溶液甲,下列叙述正确的是
A.溶液甲的pH>7
B.对溶液甲进行微热,K1、K2 同时增大
C.若在溶液甲中加入少量的 NaOH 溶液,溶液的 pH 明显增大
D.若在溶液甲中加入 5 mL 0.1 mol·L-1的盐酸,则溶液中醋酸的 K1 会变大
将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,错误的是( )

用己知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作中正确是
| A.滴定前,没有逐出滴定管下口的气泡 |
| B.用甲基橙作指示剂,指示剂刚变色,就停止滴定 |
| C.酸式滴定管用蒸馏水洗净后,直接加入己知浓度的盐酸 |
| D.锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液 |
某学生的实验报告所列出的下列数据中合理的是( )
| A.用1mol的醋酸溶液和1.01mol的氢氧化钠溶液做中和热实验测得中和热的数值为57.3kJ/mol |
| B.通过实验得知在常温常压下,12g固体C和32g气体O2所具有的总能量一定大于44g气体CO2所具有的总能量 |
| C.室温下,用广泛pH试纸测得某溶液的pH为2.3 |
| D.用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.7mL |
某次酸雨的分析数据如下:c(NH4+)=2.0×10—5 mol·L—1,c(Cl —)=6.0×10—5 mol·L—1,c(Na+)= 1.9×10—5 mol·L—1,c(NO3—)=2.3×10—5 mol·L—1,c(SO42—)=2.5×10—5 mol·L—1,则此次酸雨的pH大约为
| A.3 | B.4 | C.5 | D.6 |
水是一种极弱的电解质,在室温下,平均每n个水分子中只有1个水分子发生了电离,则n的值是 ( )
| A.1×10-14 | B.55.6×107 | C.107 | D.55.6 |
试题篮
()