已知醋酸、醋酸根离子在溶液中存在下列平衡:
| CH3COOH+H2O |
C H3COO-+H3O+ |
K1=1.75×10-5 mol·L-1 |
| CH3COO-+H2O |
CH3COOH+OH- |
K2=5.71×10-10 mol·L-1 |


 现将 50 mL 0.2 mol·L-1醋酸与 50 mL 0.2 mol·L-1醋酸钠溶液混合制得溶液甲,下列叙述正确的是
现将 50 mL 0.2 mol·L-1醋酸与 50 mL 0.2 mol·L-1醋酸钠溶液混合制得溶液甲,下列叙述正确的是
A.溶液甲的pH>7
B.对溶液甲进行微热,K1、K2 同时增大
C.若在溶液甲中加入少量的 NaOH 溶液,溶液的 pH 明显增大
D.若在溶液甲中加入 5 mL 0.1 mol·L-1的盐酸,则溶液中醋酸的 K1 会变大
欲用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,下列有关说法正确的是
| A.滴定管在装溶液前,先用蒸馏水洗涤干净后,再用待装溶液润洗 |
| B.锥形瓶在装待测溶液前,先用蒸馏水洗涤干净后,再用待装溶液润洗 |
| C.滴定过程中,两眼注视滴定管装液面的变化 |
| D.装标准液的滴定管中有气泡而滴定前未排出,则滴定结果将偏低 |
将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,错误的是( )

某酸HX稀溶液和某碱YOH稀溶液的物质的量浓度相等,两溶液混合后,溶液的pH大于7,下表中判断合理的是 ( )
| 编号 |
HX |
YOH |
溶液的体积关系 |
| ① |
强酸 |
强碱 |
V(HX)=V(YOH) |
| ② |
强酸 |
强碱 |
V(HX)<V(YOH) |
| ③ |
强酸 |
弱碱 |
V(HX)=V(YOH) |
| ④ |
弱酸 |
强碱 |
V(HX)=V(YOH) |
A、①③ B、②③ C、①④ D、②④
已知酸H2B在水溶液中存在下列关系:①H2B=H++HB-,②HB- H++B2- ,则下列说法中一定正确的是
H++B2- ,则下列说法中一定正确的是
A、在Na2B溶液中一定有:c(OH )=c(H
)=c(H )+c(HB
)+c(HB )+2c(H2B)
)+2c(H2B)
B、NaHB溶液可能存在以下关系:c(Na )>c(HB
)>c(HB )>c(OH
)>c(OH )>c(H
)>c(H )
)
C、NaHB水溶液中一定有:c(Na )+c(H
)+c(H )=c(HB
)=c(HB )+c(OH
)+c(OH )+c(B
)+c(B )
)
D、NaHB溶液一定呈酸性,Na2B溶液一定呈碱性
实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是
| A.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度 |
| B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 |
| C.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次 |
| D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次 |
用己知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作中正确是
| A.滴定前,没有逐出滴定管下口的气泡 |
| B.用甲基橙作指示剂,指示剂刚变色,就停止滴定 |
| C.酸式滴定管用蒸馏水洗净后,直接加入己知浓度的盐酸 |
| D.锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液 |
在标有“20℃,25mL”的滴定管内装溶液至刻度“0”时,管内液体的体积
| A.约为5mL | B.大于25mL | C.等于25mL | D.小于25mL |
常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是
A. <1.0×10-7mol/L <1.0×10-7mol/L |
| B.c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3) |
| C.c(H+)+c(NH4+)>c(OH-)+ c(HCO3-)+2 c(CO32-) |
| D.c(Cl-)> c(HCO3-) >c(NH4+) > c(CO32-) |
下列说法正确的是
| A.25℃时,pH=3的CH3COOH溶液加水稀释10倍后,pH=4 |
| B.25℃时,pH=11的NaOH溶液加水稀释100倍后,pH=9 |
| C.25℃时,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后,pH=7 |
| D.90℃时,纯水的pH=6.2,所以加热可以使水呈酸性 |
25℃时,水的电离达到平衡:H2O H++OH-;DH>0,则下列叙述正确的是
H++OH-;DH>0,则下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.将水加热,KW增大,pH不变 |
下列说法不正确的是( )
A.已知氢气的燃烧热为285.8kJ/mol,相应的热化学方程式为H2(g)+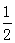 O2(g)=H2O(g),△H="-285.8" kJ/mol O2(g)=H2O(g),△H="-285.8" kJ/mol |
| B.中和相同体积、相同物质的量浓度的①硫酸,②盐酸和③醋酸所需相同浓度的NaOH溶液的体积关系:V1>V2=V3 |
| C.稀氨水中部分粒子的浓度大小关系:c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+) |
| D.1mol/LNaX和1mol/LNaY两种盐溶液中c(X-)=c(Y-)+c(HY),则HX为强酸 |
已知水的电离平衡曲线如图所示,下列说法正确的是( )
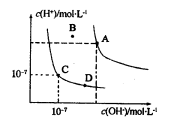
A.水的离子积常数关系为:Kw(B)>Kw(A)>Kw(C)>Kw(D)
B.保持温度不变,向水中加入醋酸钠固体,可从C点到D点
C.B点对应的温度下,pH=4的硫酸与pH=10的氢氧化钠溶液等体积混合,溶液的pH="7"
D.温度升高可实现由C点到D点
常温下,0.1mol/L的下列溶液中,水的电离程度大小排列顺序正确的是( )
①AlCl3 ②KNO3 ③NaOH ④NH3·H2O
| A.①>②>③>④ | B.①>②>④>③ | C.③>④>②>① | D.①=②=③=④ |
某学生的实验报告所列出的下列数据中合理的是( )
| A.用1mol的醋酸溶液和1.01mol的氢氧化钠溶液做中和热实验测得中和热的数值为57.3kJ/mol |
| B.通过实验得知在常温常压下,12g固体C和32g气体O2所具有的总能量一定大于44g气体CO2所具有的总能量 |
| C.室温下,用广泛pH试纸测得某溶液的pH为2.3 |
| D.用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.7mL |
试题篮
()