室温下,水的电离达到平衡H2O H++OH−。下列叙述正确的是( )
H++OH−。下列叙述正确的是( )
| A.加热,平衡向正反应方向移动,Kw不变 |
| B.向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大 |
| C.向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH−)降低 |
| D.向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(OH−)=c(H+) |
下列说法正确的是( )
| A.0.1mol/LCH3COOH溶液加水稀释,溶液中c(OH-)增大 |
| B.将NaOH和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的1/2 |
| C.相同浓度的HCl和CH3COOH,两溶液中c(H+)相同 |
| D.甲溶液的pH是5,乙溶液的pH是4,则甲溶液与乙溶液的中c(H+)之比为10:1 |
将纯水加热至较高温度,下列叙述正确的是
| A.Kw变大、pH变小、呈酸性 | B.Kw变大、pH不变、呈中性 |
| C.Kw变小、pH变大、呈碱性 | D.Kw变大、pH变小、呈中性 |
25 ℃时,在等体积的①pH=0的H2SO4溶液,②0.05 mol·L-1的Ba(OH)2溶液中,发生电离的水的物质的量之比是( )
| A.1∶10 | B.1∶5 | C.1∶20 | D.1∶10 |
室温下,将1.000mol·L-1盐酸滴入20.00mL 1.000mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示.下列有关说法正确的是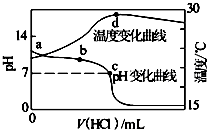
| A.a点由水电离出的c(H+)=1.0×10-14mol·L-1 |
| B.b点:c(NH4+)+c(NH3•H2O)=c(Cl-) |
| C.c点:c(Cl-)=c(NH4+) |
| D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热 |
室温下pH=13的NaOH溶液与pH=2的H2SO4溶液混合,所得溶液的pH=11,则NaOH溶液与H2SO4溶液的体积比是
| A.11:1 | B.9:1 | C.1:11 | D.1:9 |
水的电离平衡曲线如图所示,下列说法不正确的是 
| A.图中四点KW间的关系:A=D<C<B |
| B.若从A点到C点,可采用温度不变在水中加少量的CH3COONa固体 |
| C.若从A点到D点,可采用温度不变在水中加入少量酸 |
| D.若处在B点所在的温度,将pH=2的硫酸与pH=10的NaOH的两种溶液等体积混合后,溶液显中性 |
下列叙述正确的是
| A.盐酸中滴加氨水至中性,溶液中溶质为氯化铵 |
| B.稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小 |
| C.饱和石灰水中加入少量CaO,恢复至室温后溶液的pH不变 |
| D.沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强 |
在一定体积pH = 12的Ba(OH)2溶液中,逐滴加入pH = 2的NaHSO4溶液,当溶液的pH 恰好为7时,则参加反应的Ba(OH)2溶液与NaHSO4溶液的体积比是
| A.1∶9 | B.1∶1 | C.1∶2 | D.1∶4 |
25℃时,向20.00 mL的NaOH溶液中逐滴加入某浓度的CH3COOH溶液。滴定过程中,溶液的pH与滴入CH3COOH溶液的体积关系如图所示,点②时NaOH溶液恰好被中和。则下列说法中,错误的是
| A.CH3COOH溶液的浓度为0.1 mol·L-1 |
| B.点④所示溶液中存(CH3COOH)+c(H+)=c(CH3COOH-)+c(OH-) |
| C.图中点①到点③所示溶液中,水的电离程度先增大后减小 |
| D.滴定过程中会存在:c(Na+)> c(CH3COOH-)= c(OH-) > c(H+) |
常温下向20 mL 0.1mol/LCH3COOH溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( )

| A.a点表示的溶液中c(CH3COO-)略小于10-3 mol/L |
| B.b点表示的溶液中c(CH3COO-)>c(Na+) |
| C.c点表示CH3COOH和NaOH恰好完全中和 |
| D.滴定过程中溶液中的n (CH3COO-) +n(CH3COOH)的和不变 |
以0.10 mol/L的氢氧化钠溶液滴定某一元酸HA的滴定曲线如图所示。下列表述正确的是
| A.此实验可以选用甲基橙作指示剂 |
| B.该酸HA的浓度约为1×10-4 mol/L |
| C.当NaOH体积为9 mL时,恰好完全中和反应 |
| D.达到滴定终点时,溶液中c(Na+)>c (A-) |
试题篮
()