(8分)A、B代表不同物质,都是H、N、O三种元素组成的强电解质,A、B的水溶液都呈酸性,且相同浓度时,A溶液抑制水的电离,B溶液中促进水的电离。
(1)写出化学式A________, B________;
(2)室下,当A、B两溶液PH均为4时,两溶液中水电离出的氢离子的物质的量浓度之比为1:_;
(3)写出0.1  B溶液中离子浓度由大到小排序 ;
B溶液中离子浓度由大到小排序 ;
(1)剧烈运动后血液中产生了较多乳酸(C3H6O3),使人肌肉酸痛,经过一段时间放松,由于乳酸与吸入的氧气反应,生成二氧化碳和水,酸痛感消失。此反应的化学方程式为: 。
(2)人的纯净胃液是一种无色液体,呈酸性,pH在0.9~1.5之间, 其中H+ 的浓度比血液中高几万倍,回答下列问题:
①胃液有帮助人体消化食物等多种功能,胃酸的主要成分是 。
②若胃酸酸度增高就会患胃酸过多症,下列物不宜用做治疗胃酸过多的药物是( )
| A.小苏打粉 | B.氢氧化铝 粉 粉 |
C.氧化钙粉末 | D.纯碳酸钙粉 |
③胃舒平主要成分是氢氧化铝,不溶于水且作用持久,写出该药物中和胃酸的化学方程式: 。
0.1mol/L的下列溶液, pH由小到大排列顺序为 (填编号);实验室配制⑤的溶液时常需加入少量盐酸,否则得到的是混浊的溶液,产生混浊的原因是(用离子方程式表示): 。
①HCl、②CH3COOH、③CH3COONa、④NaOH、⑤FeCl3、⑥NaCl 。
现有浓度均为0.1 mol/L的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵⑤硫酸铝 ⑥碳酸氢钠。请回答下列问题:
(1)①②③④四种溶液中由水电 离出的H+浓度由大到小的顺序是 (填序号)。
离出的H+浓度由大到小的顺序是 (填序号)。
(2)已知T℃,Kw = 1×10-13,则T℃ (填“>”、“<”、“=”)25℃。在T℃时,将pH = 11的③溶液a L与pH = 1的①溶液b L混合(忽略混合后溶液体积的变化),若所得溶液的pH = 10,则a:b = 。
(3)将⑤溶液和⑥溶液混合时,可看到的实验现象是 ,产生该现象的原因是 (用离子方程式解释原因)。
某温度(t℃)时,水的离子积为KW=1×10-13,则该温度(填“大于”、“小于”或“等于”)________25℃。若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比:
①若所得混合液为中性,则a∶b=________;此溶液中各种离子的浓度由大到小排列顺序是________________ 。
②若所得混合液的pH=2,则a∶b=________。此溶液中各种离子的浓度由大到小排列顺序是_______ _。
常温下将0.2 mol/L HCl溶液与0.2 mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
(1)①混合溶液中由水电离出的c(H+)________HCl溶液中由水电离出的c(H+)。(填“>”、“<”或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)-c(M+)=__________mol/L;c(H+)-c(MOH)=________mol/L。
(2)常温下若将0.2 mol/L MOH溶液与0.1 mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度______MCl的水解程度。(填“>”、“<”或“=”)
7分)某温度(t℃)时,水的KW=1×10-13,则该温度(填大于、等于或小于) 25℃,理由是 。
将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,
(1)若所得混合溶液为中性,则a:b= ;
(2)若所得混合溶液pH=2,则a:b= 。
⑴浓度均为0.1mol/L的8种溶液:① HNO3② H2SO4③ CH3COOH ④ Ba(OH)2 ⑤NaOH ⑥ CH3COONa ⑦ KCl ⑧ NH4Cl,溶液pH值由小到大的顺序是(填写编号) ________________。
(2)氯化铝水溶液呈 性,原因是(用离子方程式表示): ,把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 (写化学式)。
(9分)下表是不同温度下水的离子积常数:
| 温度/℃ |
25 |
t1 |
t2 |
| 水的离子积常数 |
1×10-14 |
a |
1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a________1×10-14(填“>”、“<”或“=”), 做此判断的理由是____________________________________
做此判断的理由是____________________________________ ____________________________________
____________________________________
(2)25℃时,某Na2SO4溶液中c(SO)=5×10-4 mol/L,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=________。
(3)t2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=________。此溶液中各种离子的浓度由大到小的顺序是________。
(3分)某造纸厂排出的废水,经分析其中除了含有游离汞、纤维素以及其它的有机物外,其
它成分为c(Na+)=4×10—4mol/L,c(SO42—)=2.5×10—4mol/L,c(Cl—)=1.6×10—5 mol/L,c(NO3—)
=1.4×10—5 mol/L,c(Ca2+)=1.5×10—5 mol/L,则该废水的pH为__________。
向两支分别盛有0.1mol/L醋酸和饱和硼酸(H3BO3)溶液的试管中滴加等浓度碳酸钠溶液,实验现象为(1) 三种酸由强到弱的顺序是(用化学式表示)(2) ,]硼酸(H3BO3)在食品、医药领域应用广泛。
(3) 请完成B2H6气体与水反应的化学方程式:B2H6 +6H2O=2H3BO3 +________。
(4) 在其他条件相同时,反应H3BO3 +3CH3OH  B(OCH3)3 +3H2O中,H3BO3的转化率(
B(OCH3)3 +3H2O中,H3BO3的转化率( )在不同温度下随反应时间(t)的变化见下图,由此图可得出:
)在不同温度下随反应时间(t)的变化见下图,由此图可得出: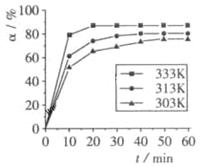
①温度对应该反应的反应速率和平衡移动的影响是____ ___
②该反应的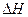 _____0(填“<”、“=”或“>”).
_____0(填“<”、“=”或“>”).
(5) H3BO 3溶液中存在如下反应: H3BO 3(aq)+H2O(l) [B(OH)4]-( aq)+H+(aq)
[B(OH)4]-( aq)+H+(aq)
已知0.70 mol·L-1 H3BO 3溶液中,上述反应于298K达到平衡时,c平衡(H+)="2." 0 × 10-5mol·L-1,c平衡(H3BO 3)≈c起始(H3BO 3),水的电离可忽略不计,此温度下该反应的平衡常数K= ,
(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)
取两支试管,分别加入4mL0.01mol/L的KMnO4溶液,然后向试管①中加入0.1mol/LH2C2O4溶液2mL,记录溶液褪色所需的时间;向试管②中加入0.2mol/L H2C2O4溶液2mL,记录溶液褪色时间,(1)实验表明 褪色更快些。
(2)写出反应的化学方程式 。
(3)在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是
① K+、Cl-、NO3-、S2- ② K+、Fe2+、I-、SO42- ③ Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3- ⑤ K+、Ba2+、Cl-、NO3- ⑥C2O42-、Br-、K+、Cl-
(1)常温下,将1 mL pH=1的H2SO4溶液加水稀释到100 mL,稀释后的溶液中= 。
(2)某温度时,测得0. 01 mol·L-1的NaOH溶液的pH为11,则在该温度下水的离子积常数KW= _,该温度 25℃。
01 mol·L-1的NaOH溶液的pH为11,则在该温度下水的离子积常数KW= _,该温度 25℃。
(3)常温下,pH=13的Ba(OH)2溶液aL与 pH=3的H2SO4溶液bL混合(混合后溶液体积变化忽略不计)。
pH=3的H2SO4溶液bL混合(混合后溶液体积变化忽略不计)。
若所得混合溶液呈中性,则a∶b=
若所得混合溶液pH=12,则a∶b=
(4)在(2)所述温度下,将pH=a的NaOH溶液VaL与pH=b的硫酸VbL混合。
若所得混合液为中性,且a=12,b=2,则Va∶Vb=
若所得混合液的pH=10,且a=12,b=2,则Va∶Vb=
试题篮
()