(4分) 一定温度下,A、B两瓶乙酸的浓度分别是1 mol/L和0.1 mol/L,则A、B两瓶乙酸溶液中[ H+ ]之比 10(填“<”、“>”或“=”),并简述理由 。
在t℃时,某NaOH稀溶液中,c(H+)=10-a mol/L,c(OH-)=10-b mol/L,已知a+b=12,则:
(1)该温度下,水的离子积常数Kw= 。
(2)该温度下,将100mL 0.1mol/L的稀硫酸与100mL 0.4mol/L的NaOH溶液混合后,溶液的pH= ,此时该溶液中由水电离的c(OH-)= mol/L。
(3)该温度下,若10体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前该强酸的pH1与强碱的pH2应满足的关系是 。
(4)该温度下,pH=3的硫酸溶液和pH=9的NaOH溶液等体积混合后,混合溶液的pH (填>7、=7、<7);pH=3的醋酸溶液和pH=9的NaOH溶液等体积混合后,混合溶液的pH (填>7、=7、<7)。
Ⅰ.由于温室效应和资源短缺等问题,如何降低大气中的 CO2含量并加以开发利用, 引起了各国的普遍重视。工业上有一种方法是用 CO2生产燃料甲醇。一 定条件下发生反应:CO2(g) +3H2(g) CH3OH(g)+H2O(g)。右图表示该 反应进行过程中能量(单位为 kJ•mol -1)的变化。
(1) 为探究反应原理,现进行如下实验:T1℃时,在体积为 1L 的密闭容器中,充入 1mol CO2和 3mol H2,测得CO2和 CH3OH(g) 的浓度随时间变化如 图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率 v(H2) 为 mol•L-1•min-1。
(2)温度变为 T2℃(T1 > T2),平衡常数 K (填“增大”、 “不变”或“减小”)。
(3)下列措施中能使 n(CH3OH)/n(CO2)增大的有
A升高温度 B加入催化剂 C将 H2O(g)从体系中分离
D再充入 1molCO2和 3molH2 E.充入 He(g),使体系总压强增大。
Ⅱ.在温度 t℃,某 NaOH 的稀溶液中 c(H+)=10—amol/L,c(OH—)=10—bmol/L,已知 a+b=12,该温度下水的离子积 Kw= ;t 25℃(填“大于”、“小于”或“等于”)。
向该溶液中逐滴加 pH=c 的盐酸(t℃),测得混合溶液的部分 pH 如右表 所示。假设溶液混合前后的体积变化 忽略不计,则 c 为
研究碳及其化合物的性质和用途是中学化学的任务之一。
I.某兴趣小组在实验室中制备碳酸钠溶液。方案如下:步骤一,取25 mL一定浓度的NaOH溶液,通人CO2气体至过量;步骤二,加热煮沸步骤一所得溶液;步骤三,另取25 mL相同浓度的NaOH溶液与步骤二所得溶液混合,即得碳酸钠溶液。
(1)完成步骤一可选的化学试剂有:稀盐酸、NaOH溶液、大理石、饱和碳酸钠溶液、稀硫酸、饱和碳酸氢钠溶液等,需要的装置如下所示。
①各装置正确的连接顺序为 (用a、b、c、d表示)。
②检查整套装置气密性的方法是 。
③装置A中常用药品为 ;装置C中化学药品的作用是 。
(2)写出步骤三中发生反应的离子方程式 。
(3)有同学提出“步骤二”没有必要,请你简述自己的看法 。
Ⅱ.实验室用纯碱和盐酸处理某种蛇纹石(已知蛇纹石中含有MgO、SiO2.CaO、Fe2O3、Al2O3等氧化物)模拟制备氧化镁的流程如下:
(1)过滤需要的玻璃仪器有 。
(2)沉淀Ⅱ的成分为 ,请用离子方程式表示生成沉淀的过程 (写出一个即可)。
(3)纯碱溶液中所有离子浓度的大小关系为 。
(4)已知l0%的纯碱溶液密度为1.06g/cm3,则其物质的量浓度为____ ,
2SO2(g)+O2(g) 2SO3(g)是生产硫酸的主要反应之一。下表是原料气按
2SO3(g)是生产硫酸的主要反应之一。下表是原料气按 投料,在
投料,在 时,不同温度下SO2的平衡转化率。
时,不同温度下SO2的平衡转化率。
(1)该反应是_ 反应(填“放热”或“吸热”)。
(2) 时,将含10 mol SO2的原料气通入一密闭容器中进行反应平衡时SO2的物质的量是 mol。
时,将含10 mol SO2的原料气通入一密闭容器中进行反应平衡时SO2的物质的量是 mol。
(3)硫酸厂尾气(主要成分为SO2、O2和N2)中低浓度SO2的吸收有很多方法。
①用氨水吸收上述尾气,若尾气中SO2与氨水恰好反应得到弱碱性的(NH4)2SO3溶液,则有关该溶液的下列关系正确的是 (填序号)。
②用MnO2与水的悬浊液吸收上述尾气并生产MnSO4
i.得到MnSO4的化学方程式是
ii.该吸收过程生成MnSO4时,溶液的pH变化趋势如图甲,SO2的吸收率与溶液pH的关系如图乙。
图甲中pH变化是因为吸收中有部分SO2转化为H2SO4生成H2SO4反应的化学方程式是____;由图乙可知pH的降低 SO2的吸收(填“有利于”或“不利于”),用化学平衡移动原理解释其原因是 。
在自来水消毒和工业上砂糖、油脂的漂白与杀菌过程中,亚氯酸钠(NaClO2)发挥着重要的作用。下图是生产亚氯酸钠的工艺流程图: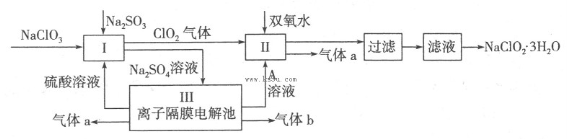
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出
NaClO2·3H2O;
②常温下,Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-28;Ksp(PbS)=2.4 ×10-28
(1)反应I中发生反应的离子方程式为 。
(2)从滤液中得到NaClO2·3H2O晶体的所需操作依次是 (填写序号)。
a.蒸馏 b.蒸发浓缩 c.过滤 d.冷却结晶 e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
| 弱酸 |
HClO2 |
HF |
H2CO3 |
H2S |
| Ka/mol·L-1 |
1×10-2 |
6.3×10-4 |
K1=4.30×10-7 K2=5.60×10-11 |
K1=9.1×10-8 K2=l.1×10-12 |
①常温下,物质的量浓度相等的NaClO2、NaF、NaHCO3、Na2S四种溶液的pH由大到小的顺序为 (用化学式表示);体积相等,物质的量浓度相同的NaF、NaClO2两溶液中所含阴阳离子总数的大小关系为: (填“前者大”“相等”或“后者大”)。
②Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是 ;常温下,当最后一种离子沉淀完全时(该离子浓度为10-5mol·L-1)此时体系中的S2-的浓度为 。
(4)Ⅲ装置中生成气体a的电极反应式 ,若生成气体a的体积为1.12L(标准状况),则转移电子的物质的量为 。
硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:
SO2(g)+2CO(g)=2CO2(g)+1/xSx(s) △H=akJ/mol
2COS(g)+SO2(g)=2CO2(g)+3/xSx(s) △H=bkJ/mol。
则COS(g)生成CO(g)与Sx(s)反应的热化学方程式是 。
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3和HNO3有如下反应:
As2S3+10H++ 10NO3−=2H3AsO4+3S+10NO2↑+ 2H2O,当生成H3AsO4的物质的量
为0.6 mol反应中转移电子的数目为 ,
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS−、S2−的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。
①B表示 。
②滴加过程中,溶液中微粒浓度大小关系正确的是 (填字母)。 a.c(Na+)= c(H2S)+c(HS−)+2c(S2−)
a.c(Na+)= c(H2S)+c(HS−)+2c(S2−)
b.2c(Na+)=c(H2S)+c(HS−)+c(S2−)
c.c(Na+)=3[c(H2S)+c(HS−)+c(S2−)]
③NaHS溶液呈碱性,当滴加盐酸至M点时,溶液中各离子浓度由大到小的顺序为  (4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
(4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
① 写出反应器中发生反应的化学方程式是 。
② 电渗析装置如右图所示,写出阳极的电极反应式 。该装置中发生的总反应的化学
试题篮
()