(1)常温下,将pH=10和pH=12的NaOH溶液以1∶1的体积比混合,则混合后所得溶液的pH约为________。
(2)0.2 mol·L-1 NaHSO4和0.1 mol·L-1 BaCl2溶液按等体积混合后,则溶液的pH等于________。
(3)用pH=4和pH=11的强酸和强碱混合,使pH=10,则两溶液的体积比为________。
(1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,混合溶液中由水电离出的c(H+)_______0.2mol/LHCl溶液中由水电离出的c(H+)(填“>”、“<”、或“=”) 。
(2)常温下若将0.2mol/L MOH溶液与0.1mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度__________MCl的水解程度。(填“>”、“<”、或“=”)
(3)常温下若将0.1mol/L的HR溶液与0.1mol/L的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH_____________。(填“>7”、“<7”、或“无法确定”)
(4)用0.1000mol/L HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
| 实验序号 |
0.1032mol/L HCl溶液体积/mL |
待测NaOH溶液体积/mL |
| 1 |
27.83 |
25.00 |
| 2 |
26.53 |
25.00 |
| 3 |
27.85 |
25.00 |
①待测NaOH溶液的物质的量浓度为________________mol/L。(保留四位有效数字)
②下列情况可能引起测定结果偏高的是____________。
A.酸式滴定管未用标准盐酸溶液润洗 B.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
C.锥形瓶未用待测液润洗 D.酸式滴定管滴定前平视读数,滴定后俯视读数
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等.沉淀滴定所用的指示剂本身就是一种沉淀剂.已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
| 化学式 |
AgCl |
AgBr |
AgI |
Ag2S |
Ag2CrO4 |
| 颜色 |
白色 |
浅黄色 |
黄色 |
黑色 |
红色 |
| Ksp |
1.8×10﹣10 |
5.0×10﹣13 |
8.3×10﹣17 |
2.0×10﹣48 |
1.8×10﹣10 |
滴定时,你认为该滴定适宜选用的指示剂是下列中的_________________。
A.KBr B.KI C.K2S D.K2CrO4
25℃时,下列各组离子在特定溶液中一定能大量共存的是( )
| A.由水电离的c(H+)=1×10﹣14mol•L﹣1的溶液中:Ca2+、K+、Cl﹣、HCO3﹣ |
| B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2﹣、Cl﹣ |
| C.在pH=0的溶液中:Na+、NO3﹣、SO32﹣、K+ |
| D.pH=12的溶液:K+、Na+、CH3COO﹣、Br﹣ |
在一定体积某浓度的Ba(NO3)2溶液中,逐滴加入pH=1的稀硫酸至溶液中的Ba2+恰好完全沉淀时,测得溶液pH=2,若忽略两溶液混合时的体积变化,则稀硫酸的体积与Ba(NO3)2溶液的体积比是( )
| A.10∶1 | B.1∶10 | C.9∶1 | D.1∶9 |
现使用酸碱中和滴定法测定市售白醋的总酸量(g/100 mL)。
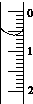
Ⅰ.实验步骤
(1)用________(填仪器名称)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到
100 mL________(填仪器名称)中定容,摇匀即得待测白醋溶液。
(2)取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴________作指示剂。
(3)读取盛装0.100 0 mol/L NaOH 溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为_______mL。
(4)滴定。当____________________________________________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录
| 滴定次数实验数据(mL) |
1 |
2 |
3 |
4 |
| V(样品) |
20.00 |
20.00 |
20.00 |
20.00 |
| V(NaOH)(消耗) |
15.95 |
15.00 |
15.05 |
14.95 |
Ⅲ.数据处理与讨论
(1)甲同学在处理数据时计算得:平均消耗的NaOH溶液的体积
V=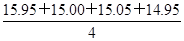 mL=15.24 mL
mL=15.24 mL
指出他的计算的不合理之处:______________________________________
按正确数据处理,可得c(市售白醋)=________mol/L;市售白醋总酸量________g/100 mL。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是________
A.碱式滴定管在滴定时未用标准NaOH溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出
室温下,用0.100mol/L NaOH溶液分别滴定20.00ml 0.100 mol/L 的盐酸和醋酸,滴定曲线如图所示,下列说法不正确的是( )
| A.Ⅱ表示的是滴定盐酸的曲线 |
| B.pH=7时,滴定盐酸消耗V(NaOH)大于滴定醋酸消耗V(NaOH) |
| C.V(NaOH)=20ml时,c(Cl-)=c(CH3COO-) |
| D.V(NaOH)=10ml时,醋酸溶液中: |
c(CH3COO- )>c(Na+ )> c(H+ )> c(OH−)
某温度下,向pH=6的纯水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,下列对该溶液的叙述中,不正确的是( )
| A.该温度高于25℃ |
| B.由水电离出来的H+的浓度是1.0×10-10mol/L |
| C.该温度下加入等体积pH=12的NaOH溶液可使该溶液恰好呈中性 |
| D.NaHSO4晶体的加入抑制了水的电离 |
室温向10mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
| A.溶液中导电粒子的数目减少 |
B.溶液中 不变 不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10ml pH=11的NaOH溶液,混合液pH=7 |
室温下,水的电离达到平衡H2O H++OH−。下列叙述正确的是( )
H++OH−。下列叙述正确的是( )
| A.加热,平衡向正反应方向移动,Kw不变 |
| B.向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大 |
| C.向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH−)降低 |
| D.向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(OH−)=c(H+) |
下图是用0.1000 mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置。请回答:
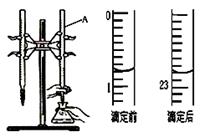
(1) 仪器A的名称是 ;
(2) 盐酸的体积读数:滴定前读数为 mL,滴定后读数为 mL 。
(3) 某实验小组同学的三次实验的实验数据如下表所示。 根据表中数据计算出的待测NaOH溶液的平均浓度是 mol/L。(保留四位有效数字)
| 实验 编号 |
待测NaOH溶液的体积(mL) |
滴定前盐酸的 体积读数(mL) |
滴定后盐酸的 体积读数(mL) |
| 1 |
20.00 |
1.20 |
23.22 |
| 2 |
20.00 |
2.21 |
24.21 |
| 3 |
20.00 |
1.50 |
23.48 |
(4)若用酚酞做指示剂,判断到达滴定终点的实验现象是_____________
(5) 对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
① 若滴定前锥形瓶未用待测液润洗,对测定结果的影响是 ;
②取待测液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失。_________
③标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是 ;
(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1;由N2和H2合成1mol NH3时可放出46.2kJ的热量。N-H键的键能是_________
(2)由氢气和氧气反应生成1mol水蒸气,放热241.8KJ。写出该反应的热化学方程式:① 。
已知常温下NO与O2反应生成1molNO2的焓变为-57.07KJ,1molNO2与H2O反应生成HNO3溶液和NO的焓变为-46KJ,写出NO与O2及水生成HNO3溶液的热化学方程式② 。
(3)某温度下纯水中的c(H+) = 2×10-7mol/L,则此时c(OH-) =________mol/L,该纯水的pH_______(填“>7”、“<7”、“=7”)。若温度不变,滴入稀硫酸使c(H+) = 5×10-6mol/L,则c(OH-) =________mol/.
(4)纳米MgO可用于尿素与氯化镁合成。某小组研究该反应在温度为378~398K时的反应时间、反应物配比等因素对其产率的影响。请完成以下实验设计表:
| 编号 |
温度/K |
反应时间/h |
反应物物质的量配比 |
实验目的 |
| ① |
378 |
3 |
3:1 |
实验②和④探究a 实验②和b 探究反应时间对产率的影响 |
| ② |
378 |
4 |
4:1 |
|
| ③ |
378 |
3 |
c |
|
| ④ |
398 |
4 |
4:1 |
下列说法正确的是( )
| A.0.1mol/LCH3COOH溶液加水稀释,溶液中c(OH-)增大 |
| B.将NaOH和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的1/2 |
| C.相同浓度的HCl和CH3COOH,两溶液中c(H+)相同 |
| D.甲溶液的pH是5,乙溶液的pH是4,则甲溶液与乙溶液的中c(H+)之比为10:1 |
将纯水加热至较高温度,下列叙述正确的是
| A.Kw变大、pH变小、呈酸性 | B.Kw变大、pH不变、呈中性 |
| C.Kw变小、pH变大、呈碱性 | D.Kw变大、pH变小、呈中性 |
试题篮
()