下列说法正确的是
| A.某盐的水溶液呈酸性,该盐一定是强酸弱碱盐 |
| B.弱电解质溶液稀释后,溶液中各种离子浓度一定都减小 |
| C.水的离子积常数KW随着温度的升高而增大,说明水的电离是吸热反应 |
| D.中和相同体积、相同pH的盐酸和醋酸溶液所需NaOH的物质的量相同 |
有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复) 提示:CH3COONH4溶液为中性
| 阳离子 |
Na+、Ba2+、NH4+ |
| 阴离子 |
CH3COO-、Cl-、OH-、SO42- |
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A是______ ,B是_______ 。
(2)25℃时,0.1mol·L-1 B溶液的pH=a,则B溶液中c(H+)-c(NH3·H2O)= _______(用含a的关系式表示)。
(3)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为__________ _________。
(4)在一定体积0.005 mol·L-1的C溶液中,加入一定体积的0.00125 mol·L-1的盐酸时,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是 ____________。
草酸(H2C2O4)是二元中强酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol•L-1 NaHC2O4溶液中滴加0.01 mol•L-1 NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
| A.V(NaOH)=0时,c(H+)=1×10-2 mol•L-1 |
| B.V(NaOH)<10 mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) |
| C.V(NaOH)=10 mL时,c(H+)=1×10-7 mol/L |
| D.V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4-) |
相同温度、相同浓度下的六种电解质溶液,其pH由小到大的顺序如图所示,图中:①②③代表的物质可能分别为( )

| A.NH4Cl;(NH4)2SO4;CH3COONa |
| B.(NH4)2SO4;NH4Cl;CH3COONa |
| C.(NH4)2SO4;NH4Cl;NaOH |
| D.CH3COOH;NH4Cl;(NH4)2SO4 |
相同温度下,两种弱酸HA、HB的电离平衡常数Ka(HA)>Ka(HB)。下列有关说法正确的是
A.浓度均为0.1 mol·L-1的HA、HB溶液中,其溶液的pH大小为:pH(HA)>pH(HB)
B.浓度均为0.1 mol·L-1的NaA、NaB溶液中,其溶液的pH大小为:pH(NaA)>pH(NaB)
C.等体积pH相同的HA、HB溶液,分别加入等浓度的NaOH溶液,恰好完全反应消耗的NaOH溶液体积HA比HB多
D.在0.1 mol·L-1NaA溶液中各离子浓度关系为:c(Na+)>c(A一)>c(OH一)>c(H+)
等体积的pH=12的碱溶液甲和pH=11的碱溶液乙,分别用等浓度的盐酸中和时,消耗盐酸的体积为2V甲=V乙。下列判断合理的是
| A.乙一定是弱碱 | B.甲一定是强碱 |
| C.乙一定是二元碱 | D.甲一定是一元碱 |
25℃时,将a mol·L-1一元酸HA与b mol·L-1 NaOH等体积混合后测得溶液pH=7,则下列关系一定不正确的是
| A.a=b | B.a>b | C.c(A-)=c(Na+) | D.c(A-)<c(Na+) |
下列图示与对应的叙述相符的是
| A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B.图2表示0.1000 mol·L-1NaOH溶液滴定20.00 mL 0.1000 mol·L-1CH3COOH溶液所得到的滴定曲线 |
| C.图3表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 |
| D.图4表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时v正 <v逆 |
常温下,用0.1 mol/L的NaOH溶液滴定10.0 mL0.1 mol/L的HA溶液,其滴定曲线如图所示,下列说法不正确的是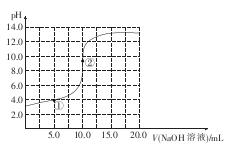
A.HA是弱酸
B.②处:c(H+)>c(OH-)
C.①处:c(Na+)<c(A-)
D.②处:c(Na+)=c(A-)+c(HA)
下列操作中,能使水的电离平衡向右移动,而且所得溶液显酸性的是
| A.在水中加入少量氯化钠,并加热到100 ℃ |
| B.在水中滴入稀硫酸 |
| C.在水中加入小苏打 |
| D.在水中加入氯化铝固体 |
pH=12的NaOH溶液100mL,要使它的pH为11。(体积变化忽略不计)
(1)如果加入蒸馏水,应加_________mL;
(2)如果加入pH=10的NaOH溶液,应加_________mL;
在一定体积pH = 12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH = 11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
| A.1∶9 | B.1∶1 | C.1∶2 | D.1∶4 |
下列说法正确的是
| A.将Ca(OH)2饱和溶液加热,溶液的pH增大 |
| B.常温下,pH=11的氨水与pH=3的盐酸等体积混合后,溶液的pH>7 |
| C.将0.1mol/L的HI溶液加水稀释l00倍,溶液中所有离子的浓度随之减小 |
| D.两种醋酸溶液的pH分别为a和(a+1),物质的量浓度分别为c1和c2,则有c1=10c2 |
中和滴定是化学定量实验之一。某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:
(1)在中和滴定的过程中有如下操作:①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液 ③检查滴定管是否漏水 ④滴定 ⑤洗涤,则在操作过程中正确的顺序是__________________。(写序号)
(2)选用的指示剂是 。(a、石蕊 b、甲基橙)
(3)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________________。
(4)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________。
| A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液 |
| B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
(5)若滴定开始和结束时,酸式滴定管中的液面如图所示,请将数据填入下面表格的空白处。
| 滴定次数 |
待测氢氧化钠溶液的体积/ mL |
0.1000 mol/L 盐酸的体积/ mL |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/ mL |
||
| 第一次 |
25.00 |
|
|
|
| 第二次 |
25.00 |
2.00 |
28.08 |
26.08 |
| 第三次 |
25.00 |
0.22 |
26.34 |
26.12 |
(6)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= 。
(7)滴定终点的判定依据是 。
试题篮
()