某溶液中仅含Na+、H+、OH-、CH3COO-四种离子,下列说法错误的是
| A.溶液中四种粒子之间可能满足:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| B.若溶液中粒子间满足:c(CH3COO-)=c(Na+),则该溶液一定呈中性 |
| C.若溶液中溶质仅为CH3COONa且浓度为0.1 mol·L-1,则粒子间一定满足: c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.若溶液中的溶质为CH3COONa和CH3COOH,则溶液中粒子间一定满足: |
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
物质在水中可能存在电离平衡、盐的水解平衡等,它们都可看作化学平衡。请根据所学的知识回答:
(1)0.01mol/L的NH4Cl溶液中各种离子的浓度由大到小顺序为 ;电荷守恒关系: ;浓度为0.01mol/L的是 ; 和 两种粒子的浓度之和是0.01mol/L。
(2 )CH3COONa溶液中存在的2个平衡体系分别为(分别用离子方程式表示): 、 ;
(3) FeCl3溶液与Na2CO3溶液混合后,反应的离子方程式为 .
下列溶液中离子浓度的关系正确的是( )
A.0.10 mol·L-1 Na2CO3溶液:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-)
B.0.1 mol·L-1 NaHA溶液,其pH等于4:c(HA-)>c(H+)>c(H 2A)>c(A2-)
C.将足量的AgCl固体分别放入5 mL水和10 mL 0.1mol·L-1的NaCl溶液中溶解至饱和,溶液中Ag+浓度前者大于后者
D.相同温度下,pH=12的NaOH溶液和pH=12的CH3COONa溶液中,水的电离程度前者大于后者
(10分)(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): ;
(2)氯化铝水溶液呈 性,(填“酸”、“中”、“碱”)性,原因是(用离子方程式表
示): ;
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(3)已知MgCl2·6H2O晶体在空气中加热时,释放部分结晶水,同时生成Mg(OH)Cl(碱式氯化镁)或生成MgO。下列是关于MgCl2·6H2O的综合应用: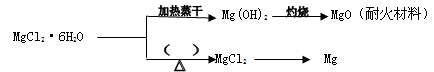
请回答下列问题:
①在上图的括号内应填的是在_______________环境中加热。
②Mg(OH)2固体存在如下溶解平衡:Mg(OH)2(固)  Mg2++2OH-。向体系中加入(请填出两种不同类别的物质)_____________________________________________________ 有利于Mg(OH)2溶解。
Mg2++2OH-。向体系中加入(请填出两种不同类别的物质)_____________________________________________________ 有利于Mg(OH)2溶解。
③已知AnBm的离子积=c (Am+) n ·c (Bn-) m,式中c (Am+) n和c (Bn-) m表示离子的物质的量浓度,在室温时若测得Mg(OH)2饱和溶液的pH值为11,其离子积为___________________。
直接排放含的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的
,
(1)用化学方程式表示形成硫酸型酸雨的反应:。
(2)在钠碱循环法中,溶液作为吸收液,可由
溶液吸收
制得,该反应的离子方程式是
(3)吸收液吸收的过程中,
随
变化关系如下表:
| 91:9 |
1:1 |
1:91 |
|
| 8.2 |
7.2 |
6.2 |
①上表判断溶液显性,用化学平衡原理解释:
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
a.,
b.
c.
(4)当吸收液的降至约为6时,需送至电解槽再生。再生示意图如下:

①在阳极放电的电极反应式是。
②当阴极室中溶液升至8以上时,吸收液再生并循环利用。简述再生原理:
在25 ml 0.1 mol · L-1NaOH溶液中逐滴加入0.2mol · L-1CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是
A.在A、B间任一点(不含A、B点),溶液中可能有c (Na+) > c (CH3COO-) >c (OH-) > c (H+)
B.在B点,a>12.5,且有c (Na+) ="c" (CH3COO-) =" c" (OH-)=" c" (H+)
C.在C点,c (CH3COO-) > c (Na+) > c (OH-) > c (H+)
D.在D点,c (CH3COO-) +c (CH3COOH) =" c" (Na+)
某二元弱酸H2A,在溶液中可以发生一级和二级电离:H2A H++HA-,HA-
H++HA-,HA- H++A2-,已知相同浓度时H2A比HA-容易电离,在相同温度时下列溶液中H2A浓度最大的是
H++A2-,已知相同浓度时H2A比HA-容易电离,在相同温度时下列溶液中H2A浓度最大的是
| A.0.01 mol/L的H2A溶液 |
| B.0.01 mol/L的NaHA溶液 |
| C.0.02 mo|/L的NaOH溶液与0.02 mol/L的NaHA溶液等体积混合 |
| D.0.02 mol/L的HCl溶液与0.04 mol/L的NaHA溶液等体积混合 |
实验测得常温下0.1mol/L某一元酸(HA)溶液的pH值等于1,0.1mol/L某一元碱(BOH)溶液里 =10-12。将此两种溶液等体积混合后,所得溶液呈的各离子的浓度由大到小排列的顺序是
=10-12。将此两种溶液等体积混合后,所得溶液呈的各离子的浓度由大到小排列的顺序是
A.c (B+)>c (A-)>c (OH-)>c (H+) B.c (A-)>c (B+)>c (H+)>c (OH-)
C.c (B+)=c (A-)>c (H+)=c (OH-) D.c (B+)>c (A-)>c (H+)>c (OH-)
下列说法正确的是:
| A.相同温度时,1mol/L氨水与0.5mol/L氨水中,C(OH-)之比是2∶1 |
| B.1mol/L NH4Cl溶液中c (NH4+) =" c" (Cl-) |
| C.0.1mol/LCH3COONa溶液中加少量CH3COOH溶液,使溶液呈中性,此时混合液中c (Na+) =" c" (CH3COO-) |
| D.硫化钠溶液中,c (Na+) =" 2" c (S2-) |
完成下列各题:
(1)在T1℃时,向容积为2L的密闭容器甲中加入1molN2、3molH2及少量固体催化剂,发生反应N2(g)+3H2(g) 2NH3(g);
2NH3(g); ,10min时各物质的浓度不再变化,测得NH3的物质的量为0.4mol。
,10min时各物质的浓度不再变化,测得NH3的物质的量为0.4mol。
①该反应在0~10min时间内H2的平均反应速率为 ;
②可以判断上述反应在体积不变的密闭容器中,反应达到平衡的是 。
A.平均相对分子质量不变 B.V正(N2)=2V逆(NH3)
C.密闭容器中总压强不变 D.N2与H2的物质的量之比为1:3
E.反应物不再转化为生成物
③在T1℃时,若起始时在容器甲中加入0.5molN2、1.5 molH2、1 molNH3,则达到平衡时NH3的物质的量为 ;(填选项字母)
A.大于0.4mol B.等于0.4mol C.小于0.4mol D.不能确定
④下图是在T1℃时密闭容器甲中H2的体积分数随时间t的变化曲线,请在该图中补画出该反应在T2℃(T2>T1)时的H2体积分数随时间t的变化曲线。
(2)已知:Al3 +与HCO3–、CO32–、HS-、S2-等能发生彻底的双水解,生活中通常利用Al3 +与HCO3–的反应来制作泡沫灭火器。泡沫灭火器的简易构造如下图,a为玻璃瓶,b为铁筒,请思考:
①参与反应的液体分别为Al2(SO4)3和NaHCO3,请问a瓶中盛放的液体为: 。
②已知苯酚是比碳酸更弱的酸,请问,苯酚钠和硫酸铝溶液混合后能否发生彻底的双水解?如能,请写出该反应的离子反应方程式: 。
已知某溶液中只存在OH-、H+、Cl-、NH4+四种离子,其离子浓度可能有如下关系:
① c(Cl—)>c(NH4+)>c(H+)>c(OH—) ② c(Cl—)>c(NH4+)>c(OH—)>c(H+)
③ c(NH4+)>c(Cl—)>c(OH—)>c(H+) ④ c(NH4+) =c(Cl—)>c(OH—)=c(H+)
下列说法正确的是: ( )
| A.若①正确,则溶液中溶质一定为NH4Cl |
| B.若③正确,则溶液中c(NH3·H2O) + c(NH4+)>c(Cl—) |
| C.若④正确,且盐酸和氨水体积相等,则盐酸中c(H+)等于氨水中c(OH—) |
| D.溶质不同时,上述四种关系式均可能成立 |
25℃时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L HA酸溶液,溶液pH变化曲线如下图所示,仔细观察下图,判断有关说法中不正确的是( )
A.HA酸是弱酸
B.当滴定过程中溶液pH=7时,c(Na+)=c(A-)>c(OH-)=c(H+)
C.在C点:c(Na+)>c(A-)>c(H+)>c(OH-)
D.在D点:c(A-)+c(HA)=2c(Na+)
氯化铵晶体溶于重水(D2O)中,溶液呈现酸性,下列叙述的原因中正确的是( )
| A.NH4+水解生成NH3·H2O和HD2O+ | B.NH4+水解生成NH3·DHO和HD2O+ |
| C.NH4+水解生成NH3·D2O和HD2O+ | D.NH4+水解生成NH3·DHO和D3O+ |
对下列各溶液中,微粒的物质的量浓度关系表述正确的是( )
| A.0.1mol·L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| B.0.1mol·L-1的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) |
| C.将0.2mol·L-1NaA溶液和0.1mol·L-1盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-) |
| D.在25℃时,1mol/L的Na2S溶液中:c(OH-)= c(H+)+c(HS-)+2c(H2S) |
试题篮
()