室温下,下列溶液中粒子浓度大小关系正确的是( )
| A.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) |
| B.Na2C2O4溶液中:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)+c(C2O42-) |
| C.Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-) |
| D.CH3COONa和CaCl2混合溶液:c(Na+)+2c(Ca2+)=c(CH3COO-)+c(CH3COOH)+c(Cl-) |
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A.pH相同的①CH3COONa②NaHCO3③NaAlO2三份溶液中的c(Na+):②>③>① |
| B.将0.5 mol/L的Na2CO3溶液与amol/L的NaHCO3溶液等体积混合, c(Na+)<c(CO32-)+c(HCO3-)+c(H2CO3) |
| C.10mL0.1mol/LCH3COOH溶液与20mL0.1mol/LNaOH溶液混合后,溶液中离子浓度关系: c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
| D.25℃某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-dmol/L |
常温下,1.0mol/L一元酸HA与等体积等浓度KOH溶液混合,所得溶液粒子的浓度关系如右表(不含水分子的5种粒子,A为短周期元素),下列说法正确的是
| 粒子 |
K+ |
A- |
X |
Y |
Z |
| 浓度(mol/L) |
0.50 |
0.49 |
c(X)>c(Y)>c(Z) |
A.元素A最高价氧化物对应水化物为HAO4
B.表格中X表示HA,Y表示H+
C.所得溶液中c(X)+ c(A-)= c(K+)
D.等体积等浓度的HA和盐酸分别加水稀释10倍后,pH (HA) >pH(HCl)
S02的含量是空气质量日报中一项重要检测指标,也是最近雾霾天气肆虐我国大部分地区的主要原因之一。加大S02的处理力度,是治理环境污染的当务之急。
I.电化学法处理SO2。
硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如右图所示(电极均为惰性材料):

(1)M极发生的电极反应式为________________。
(2)若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为 L(已知:1个e所带电量为1.6×10-19C)。
Ⅱ,溶液与电化学综合(钠碱循环法)处理SO2。
(3)钠碱循环法中,用Na2SO3溶液作为吸收液来吸收SO2,该反应的离子方程式为 。
(4)吸收液吸收SO2的过程中,pH随n(SO32-)/n(HSO3-)变化关系如右图所示:

①用图中数据和变化规律说明NaHSO3溶液呈酸性的原因 。
②n(SO32-)/n(HSO3-)=1:1时,溶液中离子浓度由大到小的顺序是 。
(5)当吸收液的pH降至约为6时,需送至电解槽处理,直至得到pH>8的吸收液再循环利用,其电解示意图如下:

①写出阳极发生的电极反应式 ;
②当电极上有2 mol电子转移时阴极产物的质量为 。
(1)CH3OH是一种可燃性的液体。
已知:① CH3OH (g)+H2O (l)=CO2 (g)+3H2 (g);△H= +93.0KJ·mol-1
② CH3OH (g)+1/2O2 (g)=CO2 (g)+2H2 (g);△H= -192.9KJ·mol-1
③ CH3OH (g)= CH3OH (l);△H= -38.19KJ·mol-1
则表示CH3OH的燃烧热的热化学方程式为
(2)燃料电池是符合绿色化学理念的新型发电装置,CH3OH—空气燃料电池是一种碱性(20%—30%的KOH溶液)燃料电池。电池放电时,负极的电极反应式为 。
(3)右图是一个电解过程示意图,假设使用CH3OH—空气燃料电池作为本过程中的电源,其中a为电解液,X和Y是两块电极板。
①若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电后,Y极板上发生的电极反应式为: 。
②若X、Y分别为石墨和铜,a为CuSO4溶液,铜片的质量变化128g,则 CH3OH一空气燃料电池理论上消耗标准状况下的空气 L(假设空气中氧气体积分数为20%)
(4)已知高锰酸钾能氧化甲醇,也能氧化草酸。查阅资料,乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸。
①请配平该反应的离子方程式:
______MnO4-+______H2C2O4+______===____Mn2++______CO2↑+______。
②某兴趣小组同学将2.52 g草酸晶体(H2C2O4·2H2O)加入到100 mL 0.2 mol·L-1的NaOH溶液中充分反应,测得反应后溶液呈酸性,形成的溶液中各离子的浓度由大到小的顺序为___________________(用离子符号表示)。
下列说法正确的是( )
A.0.1 mol·L-1 Na2CO3溶液中:c(HCO3-)=2c(H2CO3)+c(H+)-c(OH-)
B.物质的量浓度相等的Na2SO3和NaHSO3溶液中:3c(Na+)=2[c(HSO3-)+c(H2SO3)+c(SO32—)]
C.同浓度的下列溶液中,① NH4HSO4 ② NH4Cl ③ NH3·H2O,c(NH4+)由大到小的顺序是:
②>①>③
D.常温下,浓度均为0.1mol/L NaA和HA溶液中pH=8:c(HA)>c(Na+)> c(A—)> c(OH—)> c(H+)
下列叙述错误的是
| A.NaHCO3溶液中:c(H+) +c(H2CO3)=c(CO32-) +c(OH-) |
| B.25℃时,0.2mol·L-1盐酸与等体积0.05 mol·L-1Ba(OH)2溶液混合后,溶液的pH=1 |
| C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c(R2-)+c(HR-)=c(Na+) |
| D.25℃时,若0.3 mol·L-1 HY溶液与0.3 mol·L-1 NaOH溶液等体积混合后,溶液的pH=9,则: |
c(OH- )-c(HY)=c(H+)=1×10-9 mol·L-1
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g) + NaCl(s) NaNO3(s) + ClNO(g) K1 ∆H < 0 (I)
NaNO3(s) + ClNO(g) K1 ∆H < 0 (I)
2NO(g) + Cl2(g) 2ClNO(g) K2 ∆H < 0 (II)
2ClNO(g) K2 ∆H < 0 (II)
(1)4NO2(g) + 2NaCl(s)  2NaNO3(s) +2NO(g) + Cl2(g) 的平衡常数K= (用K1、K2表示)。
2NaNO3(s) +2NO(g) + Cl2(g) 的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)= mol,NO的转化率а1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”、“减小”或“不变”)。若要使K2减小,可采用的措施是 。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2 + 2NaOH ="=" NaNO3 + NaNO2 + H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol·L‾1的CH3COONa溶液,则两溶液中c(NO3—)、c(NO2—)和c(CH3COO‾)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10—4mol·L‾1,CH3COOH的电离常数K a=1.7×10—5mol·L‾1),可使溶液A和溶液B的pH相等的方法是 (选填序号)。
| A.向溶液A中加适量水 | B.向溶液A中加适量NaOH |
| C.向溶液B中加适量水 | D.向溶液B中加适量NaOH |
下列溶液中微粒的物质的量浓度关系正确的是:
| A.室温下,向0.01mol·L-1NH4HSO4溶液中滴加NaOH 溶液至中性: c(Na+)>c((SO42-)>c(NH4+)>c(OH-)=c(H+) |
| B.0.1mol·L-1NaHCO3溶液: c(Na+)>c(OH-)>c((HCO3-)>c(H+) |
| C.Na2CO3溶液:c(OH-)-c(H+)=c(HCO3-)+ 2c(H2CO3) |
| D.25℃时,,pH=4.75、浓度均为0.1mol·L-1的CH3COOH 、CH3COONa 混合溶液:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
下列比较中,正确的是
A.常温下,同浓度的一元酸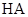 比 比 易电离,则相同浓度的 易电离,则相同浓度的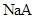 溶液比 溶液比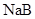 溶液的pH大 溶液的pH大 |
B.0.2 mol/L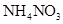 和 0.l mol/L 和 0.l mol/L 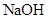 溶液等体积混合后: 溶液等体积混合后: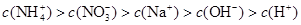 |
C.物质的量浓度相等的醋酸溶液和氢氧化钠溶液等体积混合: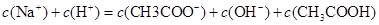 |
D.同浓度的下列溶液:①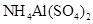 ② ②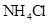 ③ ③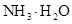 ④ ④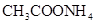 , , |
其中 由大到小的顺序是:①
由大到小的顺序是:①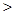 ②
②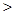 ④
④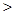 ③
③
下列溶液中离子浓度的关系一定正确的是
| A.pH相同的CH3COONa溶液、NaHCO3溶液、Na2CO3溶液:c(CH3COO-) > c(CO32-) > c(HCO3-) |
| B.pH=3的一元酸HX溶液和pH=11的一元碱MOH溶液等体积混合:c(M+) = c(X-) > c(H+) = c(OH-) |
| C.等物质的量的二元弱酸H2X与其钾盐K2X的混合溶液中:c(K+) = c(H2X) + c(HX-) + c(X2-) |
| D.氨水中加入盐酸得到的酸性溶液:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
室温下,下列溶液中粒子浓度关系不正确的是
| A.pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
| B.0.1 mol•L-1NaHCO3溶液与0.1NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) |
| C.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) |
| D.含等物质的量的NaHC2O4和Na2C2O4的溶液:2 c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
下列叙述不正确的是
| A.钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其生腐蚀 |
| B.反应SO2(g)+2H2S(g)=3S(S)+2H2O(l)在常温下能自发进行,则该反应的△H<0 |
| C.0.1mol·L-1的CH3COOH溶液加水稀释,溶液的pH和溶液中水的电离程度均增大 |
| D.常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得溶液pH<7,存在KW/c(H+)>1.0×10-7 mol·L-1 |
某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B = H++HB-,HB-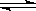 H++B2-
H++B2-
回答下列问题:
(1)Na2B溶液显 (填“酸性”“中性”或“碱性”),理由是 。(用离子方程式表示)
(2)在0.1 mol·L-1 Na2B溶液中,下列粒子浓度关系式正确的是 。
| A.c(Na+)+(OH-)=c(H+)+c(HB-) |
| B.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-) |
| C.c(Na+)=2c(B2-)+2c(HB-) |
| D.c(B2-)+ c(HB-)=0.1mol·L-1 |
(3)已知0.1 mol·L-1 NaHB溶液的pH=2,则0.1mol·L-1 H2B溶液中氢离子的物质的量浓度可能是 0.11 mol·L-1(填“<”“>”或”=”),理由是 。
(4)0.1 mol·L-1 NaHB溶液中各种离子浓度由大到小的顺序是 。
下列溶液均处于25℃,有关叙述正确的是
| A.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 |
| B.0.1 mol/L的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
| C.含有NH4+、Cl-、H+、OH-的溶液中,其离子浓度一定是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D.pH=4.5的番茄汁中c(H+) 是pH=6.5的牛奶中c(H+)的100倍 |
试题篮
()