下列溶液中微粒的物质的量浓度关系正确的是:
| A.室温下,向0.01mol·L-1NH4HSO4溶液中滴加NaOH 溶液至中性: c(Na+)>c((SO42-)>c(NH4+)>c(OH-)=c(H+) |
| B.0.1mol·L-1NaHCO3溶液: c(Na+)>c(OH-)>c((HCO3-)>c(H+) |
| C.Na2CO3溶液:c(OH-)-c(H+)=c(HCO3-)+ 2c(H2CO3) |
| D.25℃时,,pH=4.75、浓度均为0.1mol·L-1的CH3COOH 、CH3COONa 混合溶液:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
下列比较中,正确的是
A.常温下,同浓度的一元酸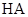 比 比 易电离,则相同浓度的 易电离,则相同浓度的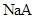 溶液比 溶液比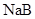 溶液的pH大 溶液的pH大 |
B.0.2 mol/L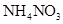 和 0.l mol/L 和 0.l mol/L 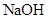 溶液等体积混合后: 溶液等体积混合后: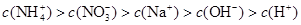 |
C.物质的量浓度相等的醋酸溶液和氢氧化钠溶液等体积混合: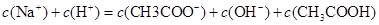 |
D.同浓度的下列溶液:①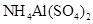 ② ②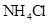 ③ ③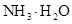 ④ ④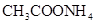 , , |
其中 由大到小的顺序是:①
由大到小的顺序是:①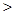 ②
②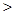 ④
④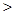 ③
③
常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通入少量CO2气体生成HX和NaHCO3;往NaY溶液中通入少量CO2生成HY和Na2CO3。下列有关叙述正确的是
| A.酸性由强至弱:HX>HY>H2CO3 |
| B.结合H+的能力:Y->CO32->X->HCO3- |
| C.溶液碱性:NaX>Na2CO3>NaY>NaHCO3 |
| D.0.1 mol·L-1Na2CO3溶液中: c(OH-)= c(HCO3-)+2 c(H2CO3) |
下列溶液中离子浓度的关系一定正确的是
| A.pH相同的CH3COONa溶液、NaHCO3溶液、Na2CO3溶液:c(CH3COO-) > c(CO32-) > c(HCO3-) |
| B.pH=3的一元酸HX溶液和pH=11的一元碱MOH溶液等体积混合:c(M+) = c(X-) > c(H+) = c(OH-) |
| C.等物质的量的二元弱酸H2X与其钾盐K2X的混合溶液中:c(K+) = c(H2X) + c(HX-) + c(X2-) |
| D.氨水中加入盐酸得到的酸性溶液:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
室温下,下列溶液中粒子浓度关系不正确的是
| A.pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
| B.0.1 mol•L-1NaHCO3溶液与0.1NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) |
| C.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) |
| D.含等物质的量的NaHC2O4和Na2C2O4的溶液:2 c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
氨水中缓缓地滴入盐酸中至中性,下列有关的说法正确的是:①盐酸过量 ②氨水过量 ③恰好完全反应 ④c (NH4+) = c(Cl-) ⑤c (NH4+) < c(Cl-) ( )
| A.①⑤ | B.③④ | C.②⑤ | D.②④ |
准确移取20.00 mL某待测HCl溶液于锥形瓶中,用0.10000 mol·L-1 NaOH溶液滴定,下列说法正确的是( )
| A.滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定 |
| B.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大 |
| C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定 |
| D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小 |
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
| 选项 |
叙述Ⅰ |
叙述Ⅱ |
| A |
测得纳米材料Fe3O4的微粒直径为90nm |
纳米材料Fe3O4属于胶体 |
| B |
C(金刚石,s)===C(石墨,s) ΔH=-1.5 kJ·mol-1 |
相同条件下,石墨比金刚石稳定 |
| C |
NaHCO3溶液呈碱性 |
NaHCO3溶液中加入少量NaOH固体,可抑制HCO3-的水解,增大c(HCO3-) |
| D |
反应物比例不同可导致产物不同 |
Na与O2反应可能生成Na2O,也可能生成Na2O2 |
常温下,下列溶液中的微粒浓度关系正确的是
| A.新制氯水中加入固体NaOH: c(Na+)=c(Cl-)+c(ClO-)+c(OH-) |
| B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3—)>c(CO32—)>c(H2CO3) |
| C.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH+4)>c(OH-)=c(H+) |
| D.0.2mol·L-1CH3COOH溶液与0.1 mol·L-1 NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c (CH3COOH) |
下列关于电解质溶液的叙述正确的是
| A.常温下,在NH4Cl溶液中离子浓度大小顺序为c(Cl—)>c(NH4+)>c(H+) > c(OH—) |
| B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
| D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH小 |
下列叙述正确的是
| A.用MgCl2·6H2O制取无水MgCl2时需在HCl气流中进行 |
| B.高锰酸钾溶液可用碱式滴定管盛装 |
| C.Al Cl3溶液蒸干可得到Al Cl3固体 |
| D.碳酸钠溶液的试剂瓶不能是玻璃瓶,可以用玻璃塞 |
下列离子方程式中,属于水解反应的是
A.HCOOH+H2O HCOO-+H3O+ HCOO-+H3O+ |
B.CO2+H2O HCO3-+H+ HCO3-+H+ |
C.CO32-+ H2O  HCO3-+OH- HCO3-+OH- |
D.HS- S2-+H+ S2-+H+ |
为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后,再加入适量的HCl,这种试剂是
| A.NH3·H2O | B.NaOH | C.Na2CO3 | D.MgCO3 |
试题篮
()