根据下表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是( )

| A.c(OH﹣)>c(H ClO)>c(H2CO3)>c(H+) |
| B.c(OH﹣)>c(HCO3﹣)>c(ClO﹣)>c(H+) |
| C.c(HClO)+c(ClO﹣)=c(HCO3﹣)+c(H2CO3) |
| D.c(Na+)+c(H+)=c(HCO3﹣)+c(ClO﹣)+c(OH﹣) |
下列说法正确的是( )
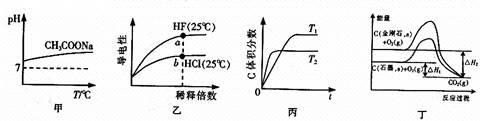
| A.由图甲可知,升高温度醋酸钠的水解程度增大 |
| B.由图乙可知,a点Kw的数值比b点Kw的数值大 |
C.由图丙可知,反应A(g)+B(g) 2C(g)是吸热反应 2C(g)是吸热反应 |
| D.由图丁可知,反应C(金刚石,s) = C(石墨,s)的焓变△H =△H1-△H2 |
物质的量浓度相同的下列溶液中:①NH4Cl ②(NH4)2CO3 ③(NH4)2SO4 ④NH4HSO4 ⑤NH4HCO3c(NH)由大到小的顺序是( )
| A.⑤②③①④ | B.④①③②⑤ | C.③②①⑤④ | D.③②④①⑤ |
物质的量浓度相同(0.1mol/L)弱酸HX和NaX溶液等体积混合后,溶液中微粒关系错误是 ( )
| A.c(Na+)+c(H+)=c(X﹣)+c(OH﹣) |
| B.c(HX)+c(X﹣)=2c(Na+) |
| C.若溶液显酸性,则有:c(X﹣)>c(Na+)>c(HX)>c(H+)>c(OH﹣) |
| D.若溶液显碱性,则有:c(Na+)>c(HX)>c(X﹣)>c(OH﹣)>c(H+) |
室温下,用0.100mol/L NaOH溶液分别滴定20.00ml 0.100 mol/L 的盐酸和醋酸,滴定曲线如图所示,下列说法不正确的是( )
| A.Ⅱ表示的是滴定盐酸的曲线 |
| B.pH=7时,滴定盐酸消耗V(NaOH)大于滴定醋酸消耗V(NaOH) |
| C.V(NaOH)=20ml时,c(Cl-)=c(CH3COO-) |
| D.V(NaOH)=10ml时,醋酸溶液中: |
c(CH3COO- )>c(Na+ )> c(H+ )> c(OH−)
下列溶液中有关物质的量浓度关系正确的是( )
A.NaHSO3溶液呈酸性,则有:c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH−)
B.pH相等的CH3COONa和Na2CO3两种溶液:c(CH3COONa)<c(Na2CO3)
C.强酸HA溶液与弱碱MOH溶液混合后溶液呈中性,则c(M+)=c(A-)
D.0.1 mol/L的 NaHA 溶液pH=1则c(Na+)=c(H2A)+c(HA-)+c(A2-)
下列化学用语的描述正确的是( )
| A.氨水显碱性:NH3·H2O=NH4++ OH− |
| B.硫酸氢钠溶液显酸性:NaHSO4=Na++ H++ SO42- |
C.Na2S溶液显碱性:S2- + 2H2O  H2S + 2OH- H2S + 2OH- |
D.AlCl3溶液显酸性:Al3+ + 3H2O Al(OH)3↓ + 3H+ Al(OH)3↓ + 3H+ |
室温下,将1.000mol·L-1盐酸滴入20.00mL 1.000mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示.下列有关说法正确的是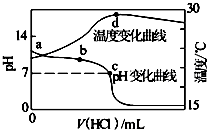
| A.a点由水电离出的c(H+)=1.0×10-14mol·L-1 |
| B.b点:c(NH4+)+c(NH3•H2O)=c(Cl-) |
| C.c点:c(Cl-)=c(NH4+) |
| D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热 |
下列有关问题,与盐的水解有关的是
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂;
②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂;
③草木灰与铵态氮肥不能混合施用;
④实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞;
⑤加热蒸干AlCl3溶液得到Al(OH)3固体。
| A.①②③ | B.②③④ | C.①④⑤ | D.①②③④⑤ |
物质的量浓度相同的下列溶液①(NH4)2CO3 ②(NH4)2SO4 ③NH4HCO3 ④NH4HSO4 ⑤NH4Cl ⑥NH3·H2O;按c(NH4+)由小到大的排列顺序正确的是
| A.③⑤④⑥①② | B.⑥③⑤④①② | C.⑥⑤③④①② | D.⑥③⑤④②① |
向体积为Va的0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系正确的是
| A.Va= Vb时:c(CH3COO-)= c(K+) |
| B.Va<Vb时:c(CH3COOH)+ c(H+)= c(OH-) |
| C.Va>Vb时:c(CH3COO-) > c(K+) > c(OH-) > c(H+) |
| D.Va与Vb任意比时:c(K+) + c(H+)= c(OH-) + c(CH3COO-) |
下列关于溶液的说法错误的有几个
①NaHCO3溶液加水稀释,c(Na+)/c(HCO3-)的比值保持增大
②浓度均为0.1 mol/L的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO32-)+c(HCO3-)]
③在0.1 mol/L氨水中滴加0.l mol/L盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH-)=l0-a mol/L
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32-)均增大
⑤在Na2S稀溶液中,c(H+)=c(OH-)+c(H2S)+c(HS-)
| A.2个 | B.3个 | C.4个 | D.5个 |
常温下测得浓度均为0.1 mol•L-1的下列三种溶液的pH:
| 溶质 |
NaHCO3 |
Na2CO3 |
NaCN |
| pH |
8.4 |
11.6 |
11.1 |
下列说法中错误的是
A.升高Na2CO3溶液的温度会使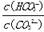 增大
增大
B.相同条件下的酸性:H2CO3>HCN
C.三种溶液中均存在电离平衡和水解平衡
D.溶液中阳离子物质的量之和的关系为:Na2CO3>NaHCO3=NaCN
试题篮
()