对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一。
请回答以下问题:
(1)硫酸工厂的酸性废水中砷(As)元素(主要以弱酸H3As03形式存在)含量极高,为控制砷的排放,某工厂采用化学沉降法处理含砷废水。
①已知砷是氮的同族元素,比氮原子多2个电子层,砷在元素周期表的位置为 ,AsH3的稳定性比NH3的稳定性 (填“强’’或“弱’’)。
②工业上采用硫化法(通常用硫化钠)去除废水中的砷,生成难溶的三硫化二砷,该反应的离子方程式为 。
(2)今年8月1 2日晚,天津滨海新区危险品仓库发生爆炸事故,少量氰化物因爆炸冲击发生泄漏,CN一有剧毒,泄露会污染水源和空气,需要处理。
①包知HCN为一元弱酸,则NaCN溶液的pH 7(填“>”“=”或“<”)。
②处理含CN一废水的方法之一是在微生物的作用下,CN-被氧气氧化成HC03一,同时生成NH3,该反应的离子方程式为
(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如右图所示(图中“HA’’表示乳酸分子,A--表示乳酸根离子)。

阳极的电极反应式为 简述浓缩室中得到浓乳酸的原理
氮元素可以形成多种氢化物,如NH3、N2H4等。
(1)据报道,2016年中国将发射“天宫二号”空间实验室,并发射“神舟十一号”载人飞船和“天舟一号”货运飞船,与“天宫二号”交会对接。火箭升空需要高能燃料,通常用肼(N2H4)作燃料,N2O4作氧化剂。已知
N2(g)+O2(g)=2NO(g)△H=+180.7kJ•mol-1
2NO(g)+O2(g)=2NO2(g)△H=-113.0kJ•mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol-1
2NO2(g) N2O4(g)△H=-52.7kJ•mol-1
N2O4(g)△H=-52.7kJ•mol-1
写出气态肼在气态四氧化二氮中燃烧生成氨气和气态水的热化学方程式:______________.
(2)工业上以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g),该反应的平衡常数和温度关系如下所示:
CO(NH2)2(l)+H2O(g),该反应的平衡常数和温度关系如下所示:
| T/℃ |
165 |
175 |
185 |
195 |
| K |
111.9 |
74.1 |
50.6 |
34.8 |
①该反应的△H 0(填“>”或“<”)。
②已知原料气中的氨碳比 为x,CO2的平衡转化率为a,在一定温度和压强下,a与x的关系如下图所示。a随着x的增大而增大的原因是__________。图中A点处,NH3的平衡转化率为__________。
为x,CO2的平衡转化率为a,在一定温度和压强下,a与x的关系如下图所示。a随着x的增大而增大的原因是__________。图中A点处,NH3的平衡转化率为__________。
(3)①在氢水加水稀释的过程中,NH3·H2O的电离程度____(填“增大”、“减小”或“不变”,下同), 的值__________。
的值__________。
②室温下,amol/L的(NH4)2SO4溶液的pH=5,原因是__________________(用离子方程式表示),该反应的平衡常数为__________(用含a的数学表达式表示)。
(1)在25℃条件下将pH=10的氨水稀释10倍后溶液的pH为(填序号)________。
A.9 B.11 C.9~10之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,溶液pH_________(填“增大”、“减小”或“不变”),主要原因是________________。
(3)已知某溶液中只存在NH4+、H+、OH-、Cl-四种离子,该溶液中各离子浓度大小顺序可能有如下几种关系:
A.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
①上述离子浓度大小关系不可能的是_________(填序号)。
②若溶液中只溶解了一种溶质,则该溶质是____________,上述离子浓度大小顺序关系中正确的是(选填序号)________________。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl) ________ c(NH3·H2O)(填>、<或=)
(4)25℃时,如果将0.1molNH4Cl和0.05molNaOH溶于水,形成混合溶液,(假设无气体逸出损失),则NH4+和NH3·H2O两种粒子的物质的量之和等于________mol。
根据题给信息,完成下列各小题:
Ⅰ、某造纸厂排出的废水,经取样分析其中除了含有游离汞、纤维素以及其它的有机物外,其它成分为c(Na+)=4×10—4mol/L,c(SO42—)=2.5×10—4mol/L,c(Cl—)=1.6×10—5 mol/L,c(NO3—)=1.4×10—5 mol/L,c(Ca2+)=1.5×10—5 mol/L,则该废水的pH为________。
Ⅱ、有四种一元酸HA、HB、HC、HD,相同物质的量浓度的NaD和NaB溶液的pH,前者比后者大;NaA溶液呈中性;1mol/L的KC溶液遇酚酞试液呈红色;同体积、同物质的量浓度的HB、HC分别作导电性试验,发现后者的导电性比前者强,则这四种酸的酸性由强到弱的顺序为______________________。
Ⅲ、常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得
溶液的pH如下表:
| 实验编号 |
HA物质的量浓度(mol/L) |
NaOH物质的量浓度(mol/L) |
混合溶液的pH |
| ① |
0.1 |
0.1 |
pH=9 |
| ② |
c |
0.2 |
pH=7 |
| ③ |
0.2 |
0.1 |
pH<7 |
请回答:
(1)从①组情况分析,HA是强酸还是弱酸__________(填“强酸”或“弱酸”);
(2)①组实验所得混合溶液中由水电离出的c(OH-)=__________mol·L-1。
(3)②组情况表明,c__________0.2 mol/L(选填“大于”、“小于”或“等于”)。
混合液中离子浓度c(A-)与c(Na+)的大小关系是___________。
(4)从③组实验结果分析,说明HA的电离程度__________NaA的水解程度(选填“大于”、“小于”或“等于”),该混合溶液中离子浓度由大到小的顺序是__________。
(本小题满分14分)
I.H2A在水中存在以下平衡:H2A 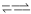 H++HA-,HA
H++HA-,HA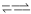 H++A2- 。
H++A2- 。
(1)NaHA溶液显酸性,则溶液中离子浓度的大小顺序为_____________。
(2)常温时,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性。此时该混合溶液的下列关系中,一定正确的是_____________。
A.c(Na+ )>c(K+ ) B.c(H +)•c(OH )=1×10-14
C.c(Na+ )=c(K+ ) D.c(Na+ )+c(K+ )=c(HA )+c(A2- )
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s) 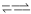 Ca2+ (aq)+A2- (aq)
Ca2+ (aq)+A2- (aq)
滴加少量Na2A固体, c(Ca2+ )_____________(填“增大”、“减小”或“不变”),原因是______________。
Ⅱ.含有Cr2O72- 的废水毒性较大,某工厂废水中含4.00×10-3 mol/L 的Cr2O7。为使废水能达标排放,作如下处理:
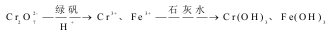
(1)该废水中加入FeSO4·7H2O和稀硫酸,发生反应的离子方程式为:_____________。
(2)欲使25 L该废水中Cr2O7转化为Cr3+,理论上需要加入_____________g FeSO4·7H2O。
(3)若处理后的废水中残留的 c(Fe )=1×10-13mol/L ,则残留的 Cr3+的浓度为____________。(已知:Ksp[Fe(OH)3]≈1.0×10-38mol,/L ,Ksp[Cr(OH)3]≈1.0×10-31 mol/L )
(10分) 25℃时,电离平衡常数:
| 化学式 |
CH3COOH |
H2CO3 |
HClO |
H2C4H4O6(酒石酸) |
H2SO3 |
| 电离平衡常数 |
2.0×10-5 |
K1=4.3×10-7 K2=5.6×10-11 |
3.0×10-8 |
K1=9.1×10-4 K2=4.3×10-5 |
K1=1.3×10-2 K2=6.3×10-8 |
回答下列问题:
(1)pH相同的下列物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,e.Na2C4H4O6;物质的量浓度由大到小的顺序是 (填字母)。
(2)常温下,0.1mol/L的CH3COOH溶液的pH== (已知lg2=0.3)。
(3)常温下,将0.1mol/L的次氯酸溶液与0.1mol/L的碳酸钠溶液等体积混合,所得溶液中各种离子浓度关系正确的是
A.c(Na+) > c(ClO-) >c(HCO3-) >c(OH-)
B.c(Na+) > c(HCO3-)>c(ClO-) > c(H+)
C.c(Na+) ==" c(HClO)" +c(ClO-)+ c(HCO3-) + c(H2CO3)+ c(CO32-)
D.c(Na+) + c(H+)== c(ClO-)+ c(HCO3-) + 2c(CO32-)
E.c(HClO) + c(H+)+ c(H2CO3)== c(OH-) + c(CO32-)
(4)写出少量的CO2通入NaClO溶液中的化学方程式 。
(5)0.1mol/L的酒石酸溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC4H4O6-)+2 c(C4H4O62-)= 。(用准确的数值表示)
常温下有下列四种溶液:
| |
① |
② |
③ |
④ |
| 溶液 |
pH=4的NH4Cl |
pH=4的盐酸 |
0.1 mol·L-1的醋酸 |
0.1 mol·L-1的NaOH |
已知该温度下醋酸的电离平稀常数Ka=1.8×10-5。请回答下列问题:
(1)用④的标准液滴定③宜选用 (填“石蕊”、“酚酞”或“甲基橙”)作为指示剂;①②溶液中由水电离出的c(H+)之比为 。
(2)将②③④三种溶液分别加水稀释10倍,pH变化最小的是 (用序号表示),用pH试纸测定溶液pH的操作方法是 。
(3)都是0.1mol/L的①NH4Cl.②NH4HCO3.③CH3COONH4.④NH4HSO4的溶液中NH4+离子浓度大小顺序为 。(用序号填写)
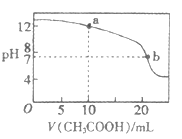
(4)取适量溶液③滴定20 mL溶液④,滴定曲线如右图所示,则a点时溶液中各离子浓度的大小关系为 。若b点时消耗③的体积为V mL,则V 20(填“>”.“<”或“=”)。
(1)室温下pH=9的NaOH溶液和pH=9的CH3COONa溶液,设由水电离产生的OH-的物质的量浓度分别为A和B,则A和B的关系为 。
(2)在纯碱溶液中滴入酚酞,溶液变红色,若在该溶液中再滴入过量的BaCl2溶液,所观察到的现象是 ,其原因是 。
(3)对于盐AmBn的溶液:
①若为强酸弱碱盐,其水解的离子方程式是 ;
②若为弱酸强碱盐,其水解的离子方程式是 。
(4)已知KSP (Ag2CrO4)=1.12×10-12,将等体积的4×10-3mo1·L-1的AgNO3和4×10-3mo1·L–1K2CrO4混合,________产生Ag2CrO4沉淀(填“能”或“不能”)。
电解质水溶液中可存在电离平衡,水解平衡,溶解平衡,依据所学回答下列问题。
(1)等物质的量浓度的下列四种溶液:①NH3·H2O ②(NH4)2SO3③KHSO3④K2SO3溶液中水的电离程度由大到小的排列顺序为________________(填序号)。
(2)体积相同、c(H+)相同的三种酸溶液①CH3COOH;②HCl;③H2SO4分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是(填序号) _____________。将c(H+)相同的三种酸均加水稀释至原来的10倍,c(H+)由大到小的顺序为_____________(填序号)。
(3)已知,H+ (aq) + OH-(aq) ="=" H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为____________。
(4)25℃时,NH3·H2O的电离常数为Kb=1.7×10-3。0.1mol·L-1NH4Cl溶液的pH=a,则c(NH4+)∶c(NH3·H2O)=_________(用含a的代数式表示)
(5)某化学研究性学习小组对电解质溶液作如下归纳总结(均在常温下),其中正确的有( )
①pH=1的强酸溶液,加水稀释后,溶液中各离子浓度一定都降低
②pH=2的盐酸与pH=13的NaOH溶液,按体积比9:1混合后的溶液pH为11
③pH相等的三种溶液:a.CH3COONa;b.NaHCO3;c.NaOH.其溶液物质的量浓度由小到大顺序为c、b、a
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42﹣)
⑤亚磷酸(H3PO3)是二元弱酸,所以Na2HPO3稀溶液一定呈碱性
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7.
⑦某二元酸在水中的电离方程式是H2B═H++HB﹣;HB﹣ H++B2﹣,则0.1mol/L的Na2B溶液中,c(Na+)=2c(B2﹣)+2c(HB﹣)
H++B2﹣,则0.1mol/L的Na2B溶液中,c(Na+)=2c(B2﹣)+2c(HB﹣)
(6)25℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,
Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33。在25℃下,向浓度均为0.1mol·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式)。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+刚好完全沉淀时,测定c(Al3+)=0.2mol·L-1。此时所得沉淀中________(填“还含有”或“不含有”)Al(OH)3。
按要求回答下列问题:
(1)实验室常用NaOH溶液来进行洗气和提纯,当100mL3mol/L的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为________________。
(2)常温下向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是______________。
A.溶液中导电粒子的数目减小
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中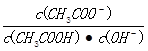 不变
不变
D.溶液中 减小
减小
(3)①常温下将0.15mol/L稀硫酸V1mL与0.1mol/LNaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2=______________________(溶液体积变化忽略不计)。
②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法正确的是
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(4)常温下,浓度均为0.1mol/L的下列五种溶液的pH值如表所示:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
①根据表中数据,将浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是____。
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是_____________。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+CO2+H2O
(5)几种离子开始沉淀时的pH如下表:
| 离子 |
Fe2+ |
Cu2+ |
Mg2+ |
| pH |
7.6 |
5.2 |
10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,________(填离子符号)先沉淀,Ksp[Fe(OH)2]___________Ksp[Mg(OH)2](填“>”、“=”或“<”)
室温下,某同学将某一元酸HX和NaOH溶液等体积混合,测得两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HX物质的量 浓度(mol/L) |
NaOH物质的 量浓度(mol/L) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c1 |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
c2 |
c2 |
pH=10 |
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,若HX为强酸,则a 7(填“>”“<”或“=”);若HX为弱酸,则a 7(填“>”“<”或“=”)。
(2)在乙组混合溶液中离子浓度c(X-)与c(Na+)的大小关系是 。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HX是 酸(填“强”或“弱”),该混合溶液中离子浓度由大到小的顺序是 。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)= mol/L。
NaHCO3是一种酸式盐,其水溶液显碱性,是重要的化工产品和化学试剂。
(1)NaHCO3俗称 ,其水溶液显碱性的原因是(用离子方程式表示) 。
(2)工业上制备NaHCO3的方法是:先向饱和食盐水通入足量的NH3,再通入过量的CO2得到NaHCO3沉淀,写出该反应的化学方程式___________________________。
(3)泡沫灭火器内含一定浓度的NaHCO3(置于铁桶内)和Al2(SO4)3溶液(置于玻璃瓶内)以及起泡剂,使用时把灭火器倒置即有泡沫状物质喷出。
①倒置灭火器时发生反应的离子方程式是___________________________;
②有人认为Na2CO3价格便宜,建议用等物质的量浓度、等体积的Na2CO3溶液代替NaHCO3溶液。你认为此建议_______(填“合理” 或“不合理”),理由是__________________。
(4)由NaHCO3和KHCO3组成的混合物,与50mL等浓度的盐酸分别反应,测得如下数据:
| |
50mL盐酸 |
50mL盐酸 |
50mL盐酸 |
| m(混合物) |
9.2 g |
15.7 g |
27.6 g |
| V(CO2)(标况) |
2.24 L |
3.36 L |
3.36 L |
①该混合物中NaHCO3的物质的量分数为 ;
②所用盐酸的物质的量浓度是 mol·L-1。
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)═CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ/mol
CH3CH=CH2(g)═CH4(g)+HC≡CH(g)△H2=+32.4kJ/mol
则相同条件下,反应C3H8(g)═CH3CH=CH2(g)+H2(g)的△H= kJ·mol-1。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为 ;放电时CO32-移向电池的 (填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH =5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二步电离,则H2CO3 HCO3-+H+的平衡常数K1= mo1/L。(已知10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1= mo1/L。(已知10-5.60=2.5×10-6)
(4)常温下,0.1 mo1/L NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是 (用简要的文字明)。
铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(主要成分为FeS2)是生产硫酸的冶炼钢铁的重要原料。高温下可发生反应:其中一个反应为:3FeS2+8O2 6SO2+Fe3O4,该过程若有1.5mol FeS2参加反应,则反应过程中转移_____ mol电子;
6SO2+Fe3O4,该过程若有1.5mol FeS2参加反应,则反应过程中转移_____ mol电子;
(2)氯化铝溶液显酸性,原因是_________________________(用离子方程式稀释);
(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素(CO(NH2)2;它易被氧化),原理如下图所示。
①电源的负极为_________(填“A”或“B”)。
②阳极室中发生的反应依次为_________、_________。
③电解结束后,阴极室溶液的pH与电解前相比将_________;若阴极共收集到气体6.72L(标准状况),则除去的尿素为________ g(忽略气体的溶解)。
(4)为了减少CO对大气的污染,某研究性学习小组拟研究利用CO和H2O反应转化为绿色能源H2。已知:2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•moL-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•moL-1
H2O(g)═H2O(l)△H=-44.0kJ•moL-1
写出CO和H2O(g)作用生成CO2和H2的热化学方程式:_________。
I.已知碳酸锂在水中的溶解度很小且随温度升高而减小,现用Na2CO3溶液和Li2SO4溶液制Li2CO3。
(1)Na2CO3溶液中离子浓度由大到小的顺序为 。
(2)写出制备Li2CO3的化学方程式 。
(3)获得Li2CO3的最佳方法是将反应后的物质 。
a.静置、过滤 b.加热后,趁热过滤 c.蒸发浓缩、冷却结晶
II.可逆反应①A(g)+2B(g) 2C(g) ②2E(g)
2C(g) ②2E(g) F(g)+G(g)分别在密闭容器的两个反应室中进行,反应室之间有可滑动、无摩擦的密封隔板。反应开始和达到平衡时有关物理量变化如图所示:
F(g)+G(g)分别在密闭容器的两个反应室中进行,反应室之间有可滑动、无摩擦的密封隔板。反应开始和达到平衡时有关物理量变化如图所示:
(4)反应①是 反应(填“放热”或“吸热”)。
(5)达到平衡I时,体系压强与反应开始时体系压强之比为 。
(6)平衡I和平衡II中,E的体积分数 (填“相等”、“不相等”、“无法确定”)。
(7)达平衡I时,计算A的转化率 (用分数表示)。
试题篮
()