(1)20℃时0.1 mol·L-1NaOH分别滴定0.1 mol·L-1HCl、0.1 mol·L-1CH3COOH的pH变化曲线如下。
根据上述曲线回答下列问题:
①测得醋酸起点pH为3,则20℃时该浓度醋酸的电离度为 ;
②滴定开始后醋酸曲线变化比盐酸快的原因是 ;
(2)25 ℃时0.1 mol·L-1的H2R水溶液中,用氢氧化钠来调节溶液pH,得到含有H2R、HR-、R2-三种微粒的溶液。当c(Na+)=c(R2-)+c(HR-)+c(H2R)时溶液的溶质为 (填化学式)。
(3)下图是某水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数。
①下列叙述正确的是 。
A.此图是1.0 mol·L-1碳酸钠溶液滴定1.0 mol·L-1 HCl溶液的滴定曲线
B.在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D.若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为7~9之间
(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵。已知弱电解质在水中的电离平衡常数(25℃)如下表:
| 弱电解质 |
H2CO3 |
NH3·H2O |
| 电离平衡常数 |
Ka1=4.30×10-7 Ka2=5.61×10-11 |
1.77×10-5 |
现有常温下0.1 mol·L-1的(NH4)2CO3溶液,
①你认为该溶液呈 性(填“酸”、“中”、“碱”),原因是 。
②就该溶液中粒子之间有下列关系式,你认为其中正确的是 。
A.c (NH4+)>c (CO32-)>c (HCO3-)>c (NH3·H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c (CO32-) + c (HCO3-) +c (H2CO3)=0.1 mol·L-1
D.c (NH4+)+ c (NH3·H2O)=2 c (CO32-) + 2c (HCO3-) +2 c (H2CO3)
A、B代表不同的物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合。要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度。请填写下列空白:
(1)写出化学式:A1___________、A2__________、B1___________、B2___________。
(2)相同温度下,当A1、B1的物质的量浓度相等时,两种溶液中水电离出的氢离子的物质的量浓度之比为________。
(3)0.1mol・L-1NaNO2溶液中离子浓度由大到小的顺序为___________________________________。
(4)B1溶液中水的电离程度小于B2溶液中水的电离程度,原因是___________。
(5)常温下,若B1、B2两种溶液的pH=5,则两溶液中由水电离出的氢离子的物质的量浓度之比为________。
完成以下四个小题:
(1)请完成下列各空:
①pH= a的CH3COOH溶液稀释100倍后所得溶液pH a +2(填“>”或“<”)
②0.01mol/LCH3COOH溶液的pH 2(填“>”或“<”);
③0.1mol/LCH3COONa溶液的pH 7(填“>”或“<”);
(2)观察比较以上三个小题,试猜想证明某酸(HA)是弱电解质的原理有两个:
一是: ;
二是: 。
(3)请你根据以上原理提出一些方案,证明HA酸是弱电解质:(只需简明写出方案,不需写出具体步骤,以下项目可不填满也可增加项目)
①
②
常温下,向25 mL 0.1 mol/L MOH溶液中逐滴加入0.2 mol/L HA溶液,曲线如图所示(体积变化忽略不计)。回答下列问题:
(1)写出MOH在水溶液中的电离方程式
(2)MOH与HA恰好完全反应时,溶液呈_____性(填“酸”、“碱”或“中”),理由是(用离子方程式表示)__ _____;此时,混合溶液中由水电离出的c(H+)__ _ 0.2 mol/L HA溶液中由水电离出的c(H+)(填“>”“<”或“=”)。
(3)写出B点混合溶液中各离子浓度的大小关系_________ _;
(4)D点时,溶液中c(A-)+c(HA)________2 c(M+)(填“>”“<”或“=”);若此时测得混合溶液的pH = 3,则 c(HA) + c(H+) = __________mol/L(数字表达式,不必具体算出结果)
经测定某溶液中只含Na+、CH3COO—、H+、OH—四种离子,已知该溶液中含有一种或两种溶质。查资料表明等物质的量浓度的醋酸和醋酸钠等体积混合后溶液呈酸性,试完成下列各题。
(1)试推测能组成这种溶液的可能的溶质或组合是 ;(用化学式表示)
(2)有关这种溶液,下列说法不正确的是( )
A.若溶液中离子间满足c(CH3COO—)>c(Na+)>c(H+)>c(OH—),则溶液中溶质一定为CH3COOH和CH3COONa
B.若溶液中离子间满足c(Na+)>c(CH3COO—)>c(OH—)>c(H+),则溶液中溶质一定只有CH3COONa
C.若溶液中c(Na+)= c(CH3COO—),则该溶液一定呈中性
D.若溶液中c(CH3COOH)>c(Na+),则溶液一定呈酸性
(3)若溶液是由体积相等的醋酸溶液和氢氧化钠溶液混合而成,而且恰好呈中性,则混合前
c(CH3COOH) c(NaOH)(填“大于”、“小于”或“等于”),混合前两溶液中分别的
c(H+) c(OH—)(同上);
(4)若溶液为等体积、等物质的量浓度的醋酸和醋酸钠溶液混合而成,则混合后溶液中的离子浓度关系正确的是 。
A.c(CH3COO—) + c(OH—) = c(Na+)+ c(H+)
B.c(CH3COO—)+ 2c(OH—)= c(CH3COOH)+2 c(H+)
C.c(Na+)>c(CH3COO—)>c(H+)>c(OH—)
D.2c(Na+)= c(CH3COOH)+ c(CH3COO—)
有A、B、C、D四种强电解质,它们均易溶于水,在水中电离时可产生下列离子:(每种物质只含一种阳离子和一种阴离子且互不重复)
| 阳离子 |
K+、Na+、Ba2+、NH4+ |
| 阴离子 |
CH3COO–、Cl–、OH–、SO42- |
已知:①A、C溶液的pH均大于7,B溶液的pH小于7,A、B溶液中水的电离
度几乎相同;D溶液焰色反应显黄色。
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)写出C溶液和D溶液反应的化学方程式: 。
(2)25℃时pH = 9的A溶液和pH = 9的C溶液中水的电离程度较小的是 (填写A或C的化学式)。
(3)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为 。
(4)室温时在一定体积0.2 mol·L–1的C溶液中,加入一定体积的0.1 mol·L–1的盐
酸时,混合溶液的pH = 13,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C
溶液与盐酸的体积比是 。
某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:
H2A H++HA- HA-
H++HA- HA- H++A2-
H++A2-
已知相同浓度时的电离度α(H2A)>α(HA-)(α表示弱电解质的电离程度),设有下列四种溶液:
A.0.01 mol·L-1的H2A溶液
B.0.01 mol·L-1的NaHA溶液
C.0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液
D.0.02 mol·L-1的NaOH与0.02 mol·L-1的NaHA溶液等体积混合液
据此,填写下列空白(填代号):
(1)c(H+)最大的是________,最小的是________。
(2)c(H2A)最大的是________,最小的是________。
(3)c(A2-)最大的是________,最小的是________。
电解质水溶液中可存在电离平衡,水解平衡,溶解平衡,依据所学回答下列问题。
(1)等物质的量浓度的下列四种溶液:①NH3·H2O ②(NH4)2SO3③KHSO3④K2SO3溶液中水的电离程度由大到小的排列顺序为________________(填序号)。
(2)体积相同、c(H+)相同的三种酸溶液①CH3COOH;②HCl;③H2SO4分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是(填序号) _____________。将c(H+)相同的三种酸均加水稀释至原来的10倍,c(H+)由大到小的顺序为_____________(填序号)。
(3)已知,H+ (aq) + OH-(aq) ="=" H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为____________。
(4)25℃时,NH3·H2O的电离常数为Kb=1.7×10-3。0.1mol·L-1NH4Cl溶液的pH=a,则c(NH4+)∶c(NH3·H2O)=_________(用含a的代数式表示)
(5)某化学研究性学习小组对电解质溶液作如下归纳总结(均在常温下),其中正确的有( )
①pH=1的强酸溶液,加水稀释后,溶液中各离子浓度一定都降低
②pH=2的盐酸与pH=13的NaOH溶液,按体积比9:1混合后的溶液pH为11
③pH相等的三种溶液:a.CH3COONa;b.NaHCO3;c.NaOH.其溶液物质的量浓度由小到大顺序为c、b、a
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42﹣)
⑤亚磷酸(H3PO3)是二元弱酸,所以Na2HPO3稀溶液一定呈碱性
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7.
⑦某二元酸在水中的电离方程式是H2B═H++HB﹣;HB﹣ H++B2﹣,则0.1mol/L的Na2B溶液中,c(Na+)=2c(B2﹣)+2c(HB﹣)
H++B2﹣,则0.1mol/L的Na2B溶液中,c(Na+)=2c(B2﹣)+2c(HB﹣)
(6)25℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,
Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33。在25℃下,向浓度均为0.1mol·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式)。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+刚好完全沉淀时,测定c(Al3+)=0.2mol·L-1。此时所得沉淀中________(填“还含有”或“不含有”)Al(OH)3。
按要求回答下列问题:
(1)实验室常用NaOH溶液来进行洗气和提纯,当100mL3mol/L的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为________________。
(2)常温下向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是______________。
A.溶液中导电粒子的数目减小
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中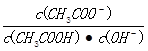 不变
不变
D.溶液中 减小
减小
(3)①常温下将0.15mol/L稀硫酸V1mL与0.1mol/LNaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2=______________________(溶液体积变化忽略不计)。
②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法正确的是
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(4)常温下,浓度均为0.1mol/L的下列五种溶液的pH值如表所示:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
①根据表中数据,将浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是____。
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是_____________。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+CO2+H2O
(5)几种离子开始沉淀时的pH如下表:
| 离子 |
Fe2+ |
Cu2+ |
Mg2+ |
| pH |
7.6 |
5.2 |
10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,________(填离子符号)先沉淀,Ksp[Fe(OH)2]___________Ksp[Mg(OH)2](填“>”、“=”或“<”)
室温下,某同学将某一元酸HX和NaOH溶液等体积混合,测得两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HX物质的量 浓度(mol/L) |
NaOH物质的 量浓度(mol/L) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c1 |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
c2 |
c2 |
pH=10 |
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,若HX为强酸,则a 7(填“>”“<”或“=”);若HX为弱酸,则a 7(填“>”“<”或“=”)。
(2)在乙组混合溶液中离子浓度c(X-)与c(Na+)的大小关系是 。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HX是 酸(填“强”或“弱”),该混合溶液中离子浓度由大到小的顺序是 。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)= mol/L。
NaHCO3是一种酸式盐,其水溶液显碱性,是重要的化工产品和化学试剂。
(1)NaHCO3俗称 ,其水溶液显碱性的原因是(用离子方程式表示) 。
(2)工业上制备NaHCO3的方法是:先向饱和食盐水通入足量的NH3,再通入过量的CO2得到NaHCO3沉淀,写出该反应的化学方程式___________________________。
(3)泡沫灭火器内含一定浓度的NaHCO3(置于铁桶内)和Al2(SO4)3溶液(置于玻璃瓶内)以及起泡剂,使用时把灭火器倒置即有泡沫状物质喷出。
①倒置灭火器时发生反应的离子方程式是___________________________;
②有人认为Na2CO3价格便宜,建议用等物质的量浓度、等体积的Na2CO3溶液代替NaHCO3溶液。你认为此建议_______(填“合理” 或“不合理”),理由是__________________。
(4)由NaHCO3和KHCO3组成的混合物,与50mL等浓度的盐酸分别反应,测得如下数据:
| |
50mL盐酸 |
50mL盐酸 |
50mL盐酸 |
| m(混合物) |
9.2 g |
15.7 g |
27.6 g |
| V(CO2)(标况) |
2.24 L |
3.36 L |
3.36 L |
①该混合物中NaHCO3的物质的量分数为 ;
②所用盐酸的物质的量浓度是 mol·L-1。
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)═CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ/mol
CH3CH=CH2(g)═CH4(g)+HC≡CH(g)△H2=+32.4kJ/mol
则相同条件下,反应C3H8(g)═CH3CH=CH2(g)+H2(g)的△H= kJ·mol-1。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为 ;放电时CO32-移向电池的 (填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH =5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二步电离,则H2CO3 HCO3-+H+的平衡常数K1= mo1/L。(已知10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1= mo1/L。(已知10-5.60=2.5×10-6)
(4)常温下,0.1 mo1/L NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是 (用简要的文字明)。
铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(主要成分为FeS2)是生产硫酸的冶炼钢铁的重要原料。高温下可发生反应:其中一个反应为:3FeS2+8O2 6SO2+Fe3O4,该过程若有1.5mol FeS2参加反应,则反应过程中转移_____ mol电子;
6SO2+Fe3O4,该过程若有1.5mol FeS2参加反应,则反应过程中转移_____ mol电子;
(2)氯化铝溶液显酸性,原因是_________________________(用离子方程式稀释);
(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素(CO(NH2)2;它易被氧化),原理如下图所示。
①电源的负极为_________(填“A”或“B”)。
②阳极室中发生的反应依次为_________、_________。
③电解结束后,阴极室溶液的pH与电解前相比将_________;若阴极共收集到气体6.72L(标准状况),则除去的尿素为________ g(忽略气体的溶解)。
(4)为了减少CO对大气的污染,某研究性学习小组拟研究利用CO和H2O反应转化为绿色能源H2。已知:2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•moL-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•moL-1
H2O(g)═H2O(l)△H=-44.0kJ•moL-1
写出CO和H2O(g)作用生成CO2和H2的热化学方程式:_________。
I.已知碳酸锂在水中的溶解度很小且随温度升高而减小,现用Na2CO3溶液和Li2SO4溶液制Li2CO3。
(1)Na2CO3溶液中离子浓度由大到小的顺序为 。
(2)写出制备Li2CO3的化学方程式 。
(3)获得Li2CO3的最佳方法是将反应后的物质 。
a.静置、过滤 b.加热后,趁热过滤 c.蒸发浓缩、冷却结晶
II.可逆反应①A(g)+2B(g) 2C(g) ②2E(g)
2C(g) ②2E(g) F(g)+G(g)分别在密闭容器的两个反应室中进行,反应室之间有可滑动、无摩擦的密封隔板。反应开始和达到平衡时有关物理量变化如图所示:
F(g)+G(g)分别在密闭容器的两个反应室中进行,反应室之间有可滑动、无摩擦的密封隔板。反应开始和达到平衡时有关物理量变化如图所示:
(4)反应①是 反应(填“放热”或“吸热”)。
(5)达到平衡I时,体系压强与反应开始时体系压强之比为 。
(6)平衡I和平衡II中,E的体积分数 (填“相等”、“不相等”、“无法确定”)。
(7)达平衡I时,计算A的转化率 (用分数表示)。
在常温下,下列五种溶液:①0.1mol/L NH4Cl ②0.1mol/L CH3COONH4 ③0.1mol/L NH4HSO4 ④0.1mol/L NH3·H2O和0.1mol/L NH4Cl混合液(pH>7) ⑤0.1mol/L NH3·H2O。
请根据要求填写下列空白:
(1)溶液①呈 性(填“酸”、“碱”或“中”),其原因是 (用离子方程式表示)。
(2)在上述五种溶液中,pH最大的是 ;c(NH4+)最大的是 ﹝填序号﹞。
(3)比较溶液②、③中c(NH4+)的大小关系是② ③﹝填“>”、“<”或“=”)。
(4)在溶液④中NH3·H2O和 的物质的量浓度之和为0.2 mol/L。
(5)常温下,测得溶液②的pH=7,则说明CH3COO-的水解程度_____(填“>”、“<”或“=”) NH4+的水解程度。
试题篮
()