25时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因(用离子方程式表示):
___________________________________________________________________;
(2)混合溶液中由水电离出的c(H+)_____(填“<”“>”“=”)0.1 mol·L-1 NaOH溶液中由水电离出的c(H+);
(3)求出混合液中下列算式的精确计算结果:
c (Na+)-c (A-)= ______________mol·L-1;
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH_____7 (填“<”“>”“=”);
(5)将相同温度下相同浓度的五种溶液:
①(NH4)2CO3 ②NH3· H2O ③(NH4)2SO4 ④NH4Cl ⑤CH3COONH4
按c(NH4+)由大到小的顺序排列___________________(填序号)。
海洋化学资源的研究和合理利用具有广阔前景,从海水中可提取氯、溴、碘等卤族元素。
(1)氯原子结构示意图是 ,碘在元素周期表中的位置是 ,HI的稳定性比HBr (填写“强”或“弱”)。
(2)向浓缩的海水中通入Cl2,可将Br-转化为Br2。再用“空气吹出法” 将Br2从浓海水中吹出,并用纯碱浓溶液吸收,生成NaBr、NaBrO3等。当有1 mol Br2被纯碱吸收时,转移的电子数为 。
下图是NaClO的发生装置。该装置主要利用了电解饱和食盐水的原理,可实现对海水的消毒和灭藻。
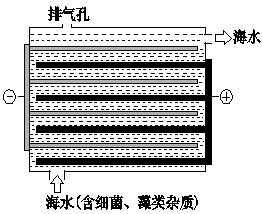
(3)写出装置中产生NaClO的化学方程式 。海水中含有Ca2+、Mg2+、HCO3-等杂质离子,处理过程中装置的阴极易产生水垢,其主要成分是Mg(OH) 2和CaCO3。 生成CaCO3的离子方程式是 。若每隔5-10 min倒换一次电极电性,可有效地解决阴极的结垢问题。试用电极反应式并结合必要的文字进行解释 。
NaOH溶液吸收SO2得Na2SO3,可用Na2SO3吸收SO2。在SO2被吸收的过程中,pH随n(SO32-)、n(HSO3-)变化关系如下:
| n(SO32-):n(HSO3-) |
91:9 |
1:1 |
1:91 |
| pH |
8.2 |
7.2 |
6.2 |
(4)从上表可判断,NaHSO3溶液呈 (填“酸性”、“碱性”、“中性”),请用平衡原理解释: 。
(5)当吸收液呈中性时,溶液中离子浓度关系正确的是 (选填字母)。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
d.c(Na+)>c(SO32-)>c(HSO3-)>c(H+)=c(OH-)
(12分)已知某二元酸(化学式用H2RO4表示)在水中的电离方程式为:
H2RO4=H++HRO4-;HRO4 H++ RO42-回答下列问题:
H++ RO42-回答下列问题:
(1)NaHRO4溶液显 (填“酸性”、“中性”或“碱性”),理由是?
(用离子方程式和必要的文字说明)。
(2)Na2RO4溶液湿 (填“酸性”、“中性”或“碱性”),理由是?
(用离子方程式表示)
(3)如果25℃时,0.1 mol/L的NaHRO4溶液中,c(RO42-)=0.029 moL/L,则0.1mol/L H2RO4溶液中c(RO42-) 0.029 mol/L(填“<”、“>”或“=”),理由是 。
(4)25℃时,0.1 mol/L的NaHR04溶液中,各离子浓度由大到小的顺序是 。
(5分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c1 |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=9 |
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸: 。
(2)不考虑其他组的实验结果,单从乙组情况分析,c1是否一定等于0.2 mol·L-1? (选填“是”或“否”)。
(3)从丙组实验结果分析,HA是 酸(选填“强”或“弱”)。
(4)写出丁组实验所得混合溶液中下列算式的精确结果(不能做近似计算)。
①c(Na+)-c(A-)= mol·L-1;
②c(OH-)-c(HA)= mol·L-1。
(8分)(1)现有0.1 mol·L-1的纯碱溶液,试用pH试纸测定溶液的pH,其正确的操作是________________________________________________________________________
________________________________________________________________________________________________________________________________________________;
纯碱溶液呈碱性的原因是(用离子方程式表示)__________________________________ ______________________________________。
(2)为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案:________ ________________________________________。
(3)为证明盐的水解是吸热反应,四位学生分别设计了如下方案,其中正确的是________。
| A.甲学生:在醋酸钠溶液中滴入2滴酚酞,加热后红色加深,说明盐类水解是吸热反应 |
| B.乙学生:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热反应 |
| C.丙学生:将硝酸铵晶体溶于水,水温下降,说明盐类水解是吸热反应 |
| D.丁学生:在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热反应 |
(8分)
(1)常温下,0.10 mol/L NH4Cl溶液pH____7(填>、=、<),溶液中各离子浓度由大到小的顺序是_________________。
(2)相同物质的量浓度的Na2S溶液与NaHS溶液,pH大小: Na2S____NaHS(填>、=、<),两种溶液中微粒种类:Na2S_______NaHS(填>、=、<)。
(3)NaHCO3溶液呈碱性的原因是__________________(写出有关的离子方程式,下同),Al2(SO4)3溶液呈酸性的原因是________________,将NaHCO3溶液跟Al2(SO4)3溶液混合,现象是________________,相关反应的离子方程式是:______________________ 。
某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
| 开始沉淀的pH |
2.3 |
7.6 |
4.4 |
| 完全沉淀的pH |
3.2 |
9.7 |
6.4 |
(1)实验室进行过滤操作所用到的玻璃仪器有 。
(2)煮沸CuSO4溶液的原因是 。向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式: 。
(3)CuCl产品中CuCl的质量分数大于96.50%为国家合格标准。称取所制备的CuCl样品0.250O g置于一定量的0.5 mol/L FeCl3溶液中,待样品完全溶解后,加水20 mL,用0.1000 mol/l的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液24.60 ml。有关的化学反应为:Fe3++CuCl=Fe2++Cu2++Cl--, Ce4++Fe2+=Fe3++Ce3+。通过计算说明该CuCl样品 (填“符合”或“不符合”)国家标准。
(4)25℃时,Ksp[Fe(OH)3]=4×10-38,Fe3+发生水解反应Fe3++3H2O Fe(OH)3+3H+,该反应的平衡常数为 。
Fe(OH)3+3H+,该反应的平衡常数为 。
电解质水溶液中可存在电离平衡,水解平衡,溶解平衡,依据所学回答下列问题。
(1)等物质的量浓度的下列四种溶液:①NH3·H2O ②(NH4)2SO3③KHSO3④K2SO3溶液中水的电离程度由大到小的排列顺序为________________(填序号)。
(2)体积相同、c(H+)相同的三种酸溶液①CH3COOH;②HCl;③H2SO4分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是(填序号) _____________。将c(H+)相同的三种酸均加水稀释至原来的10倍,c(H+)由大到小的顺序为_____________(填序号)。
(3)已知,H+ (aq) + OH-(aq) ="=" H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为____________。
(4)25℃时,NH3·H2O的电离常数为Kb=1.7×10-3。0.1mol·L-1NH4Cl溶液的pH=a,则c(NH4+)∶c(NH3·H2O)=_________(用含a的代数式表示)
(5)某化学研究性学习小组对电解质溶液作如下归纳总结(均在常温下),其中正确的有( )
①pH=1的强酸溶液,加水稀释后,溶液中各离子浓度一定都降低
②pH=2的盐酸与pH=13的NaOH溶液,按体积比9:1混合后的溶液pH为11
③pH相等的三种溶液:a.CH3COONa;b.NaHCO3;c.NaOH.其溶液物质的量浓度由小到大顺序为c、b、a
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42﹣)
⑤亚磷酸(H3PO3)是二元弱酸,所以Na2HPO3稀溶液一定呈碱性
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7.
⑦某二元酸在水中的电离方程式是H2B═H++HB﹣;HB﹣ H++B2﹣,则0.1mol/L的Na2B溶液中,c(Na+)=2c(B2﹣)+2c(HB﹣)
H++B2﹣,则0.1mol/L的Na2B溶液中,c(Na+)=2c(B2﹣)+2c(HB﹣)
(6)25℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,
Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33。在25℃下,向浓度均为0.1mol·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式)。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+刚好完全沉淀时,测定c(Al3+)=0.2mol·L-1。此时所得沉淀中________(填“还含有”或“不含有”)Al(OH)3。
按要求回答下列问题:
(1)实验室常用NaOH溶液来进行洗气和提纯,当100mL3mol/L的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为________________。
(2)常温下向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是______________。
A.溶液中导电粒子的数目减小
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中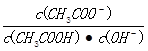 不变
不变
D.溶液中 减小
减小
(3)①常温下将0.15mol/L稀硫酸V1mL与0.1mol/LNaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2=______________________(溶液体积变化忽略不计)。
②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法正确的是
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(4)常温下,浓度均为0.1mol/L的下列五种溶液的pH值如表所示:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
①根据表中数据,将浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是____。
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是_____________。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+CO2+H2O
(5)几种离子开始沉淀时的pH如下表:
| 离子 |
Fe2+ |
Cu2+ |
Mg2+ |
| pH |
7.6 |
5.2 |
10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,________(填离子符号)先沉淀,Ksp[Fe(OH)2]___________Ksp[Mg(OH)2](填“>”、“=”或“<”)
室温下,某同学将某一元酸HX和NaOH溶液等体积混合,测得两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HX物质的量 浓度(mol/L) |
NaOH物质的 量浓度(mol/L) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c1 |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
c2 |
c2 |
pH=10 |
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,若HX为强酸,则a 7(填“>”“<”或“=”);若HX为弱酸,则a 7(填“>”“<”或“=”)。
(2)在乙组混合溶液中离子浓度c(X-)与c(Na+)的大小关系是 。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HX是 酸(填“强”或“弱”),该混合溶液中离子浓度由大到小的顺序是 。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)= mol/L。
NaHCO3是一种酸式盐,其水溶液显碱性,是重要的化工产品和化学试剂。
(1)NaHCO3俗称 ,其水溶液显碱性的原因是(用离子方程式表示) 。
(2)工业上制备NaHCO3的方法是:先向饱和食盐水通入足量的NH3,再通入过量的CO2得到NaHCO3沉淀,写出该反应的化学方程式___________________________。
(3)泡沫灭火器内含一定浓度的NaHCO3(置于铁桶内)和Al2(SO4)3溶液(置于玻璃瓶内)以及起泡剂,使用时把灭火器倒置即有泡沫状物质喷出。
①倒置灭火器时发生反应的离子方程式是___________________________;
②有人认为Na2CO3价格便宜,建议用等物质的量浓度、等体积的Na2CO3溶液代替NaHCO3溶液。你认为此建议_______(填“合理” 或“不合理”),理由是__________________。
(4)由NaHCO3和KHCO3组成的混合物,与50mL等浓度的盐酸分别反应,测得如下数据:
| |
50mL盐酸 |
50mL盐酸 |
50mL盐酸 |
| m(混合物) |
9.2 g |
15.7 g |
27.6 g |
| V(CO2)(标况) |
2.24 L |
3.36 L |
3.36 L |
①该混合物中NaHCO3的物质的量分数为 ;
②所用盐酸的物质的量浓度是 mol·L-1。
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)═CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ/mol
CH3CH=CH2(g)═CH4(g)+HC≡CH(g)△H2=+32.4kJ/mol
则相同条件下,反应C3H8(g)═CH3CH=CH2(g)+H2(g)的△H= kJ·mol-1。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为 ;放电时CO32-移向电池的 (填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH =5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二步电离,则H2CO3 HCO3-+H+的平衡常数K1= mo1/L。(已知10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1= mo1/L。(已知10-5.60=2.5×10-6)
(4)常温下,0.1 mo1/L NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是 (用简要的文字明)。
铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(主要成分为FeS2)是生产硫酸的冶炼钢铁的重要原料。高温下可发生反应:其中一个反应为:3FeS2+8O2 6SO2+Fe3O4,该过程若有1.5mol FeS2参加反应,则反应过程中转移_____ mol电子;
6SO2+Fe3O4,该过程若有1.5mol FeS2参加反应,则反应过程中转移_____ mol电子;
(2)氯化铝溶液显酸性,原因是_________________________(用离子方程式稀释);
(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素(CO(NH2)2;它易被氧化),原理如下图所示。
①电源的负极为_________(填“A”或“B”)。
②阳极室中发生的反应依次为_________、_________。
③电解结束后,阴极室溶液的pH与电解前相比将_________;若阴极共收集到气体6.72L(标准状况),则除去的尿素为________ g(忽略气体的溶解)。
(4)为了减少CO对大气的污染,某研究性学习小组拟研究利用CO和H2O反应转化为绿色能源H2。已知:2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•moL-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•moL-1
H2O(g)═H2O(l)△H=-44.0kJ•moL-1
写出CO和H2O(g)作用生成CO2和H2的热化学方程式:_________。
I.已知碳酸锂在水中的溶解度很小且随温度升高而减小,现用Na2CO3溶液和Li2SO4溶液制Li2CO3。
(1)Na2CO3溶液中离子浓度由大到小的顺序为 。
(2)写出制备Li2CO3的化学方程式 。
(3)获得Li2CO3的最佳方法是将反应后的物质 。
a.静置、过滤 b.加热后,趁热过滤 c.蒸发浓缩、冷却结晶
II.可逆反应①A(g)+2B(g) 2C(g) ②2E(g)
2C(g) ②2E(g) F(g)+G(g)分别在密闭容器的两个反应室中进行,反应室之间有可滑动、无摩擦的密封隔板。反应开始和达到平衡时有关物理量变化如图所示:
F(g)+G(g)分别在密闭容器的两个反应室中进行,反应室之间有可滑动、无摩擦的密封隔板。反应开始和达到平衡时有关物理量变化如图所示:
(4)反应①是 反应(填“放热”或“吸热”)。
(5)达到平衡I时,体系压强与反应开始时体系压强之比为 。
(6)平衡I和平衡II中,E的体积分数 (填“相等”、“不相等”、“无法确定”)。
(7)达平衡I时,计算A的转化率 (用分数表示)。
在常温下,下列五种溶液:①0.1mol/L NH4Cl ②0.1mol/L CH3COONH4 ③0.1mol/L NH4HSO4 ④0.1mol/L NH3·H2O和0.1mol/L NH4Cl混合液(pH>7) ⑤0.1mol/L NH3·H2O。
请根据要求填写下列空白:
(1)溶液①呈 性(填“酸”、“碱”或“中”),其原因是 (用离子方程式表示)。
(2)在上述五种溶液中,pH最大的是 ;c(NH4+)最大的是 ﹝填序号﹞。
(3)比较溶液②、③中c(NH4+)的大小关系是② ③﹝填“>”、“<”或“=”)。
(4)在溶液④中NH3·H2O和 的物质的量浓度之和为0.2 mol/L。
(5)常温下,测得溶液②的pH=7,则说明CH3COO-的水解程度_____(填“>”、“<”或“=”) NH4+的水解程度。
试题篮
()