甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
(1)一定温度下,在一恒容的密闭容器中,由CO和H2合成甲醇:
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
①下列情形不能说明该反应已达到平衡状态的是 (填序号)
A.每消耗1mol CO的同时生成2molH2
B.混合气体总物质的量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
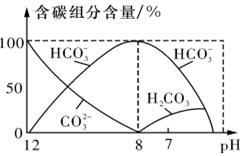
②CO的平衡转化率(α)与温度、压强的关系如下图所示。
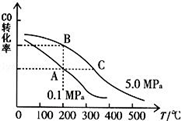
B、C两点的平衡常数K(B) K(C)(填“>”、“=”或“<”).
③某温度下,将2.0mol CO和6.0molH2充入2L的密闭容器中,达到平衡时测得c(CO)=0.25mol/L,CO的转化率= ,此温度下的平衡常数K= (保留二位有效数字)
(2)常温下,将V mL、0.20mol/L氢氧化钠溶液逐滴加入到20.00mL、0.20mol/L甲酸溶液中,充分反应,溶液pH=7,此时V 20.00(填“>”、“=”或“<”);当氢氧化钠溶液与甲酸溶液恰好完全反应时,溶液中所含离子浓度由大到小顺序__ _____
(3)温度650℃的熔融盐燃料电池,用(CO、H2)作反应物,空气与CO2的混合气体为正极反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质.该电池的正极反应式为
(4)己知:CH3OH、H2的燃烧热(△H)分别为﹣726.5kJ/mol、﹣285.8kJ/mol,则常温下CO2和H2反应生成CH3OH和H2O的热化学方程式是
研究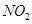 、
、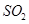 、CO等大气污染气体的测量及处理具有重要意义。
、CO等大气污染气体的测量及处理具有重要意义。
(1)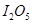 可使
可使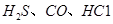 等氧化,常用于定量测定CO的含量。已知:
等氧化,常用于定量测定CO的含量。已知: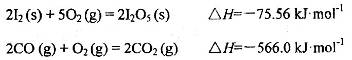
写出CO(g)与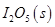 反应生成
反应生成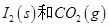 的热化学方程式:________________。
的热化学方程式:________________。
(2)CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,K+移向_______极(填“正”或“负”),正极反应方程式为:___________________。
(3)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷
酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料。
①该复合肥料可能的化学式为___________(写出一种即可)。
②若氨水与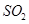 恰好完全反应生成正盐,则此时溶液呈________性(填“酸”或“碱”)。
恰好完全反应生成正盐,则此时溶液呈________性(填“酸”或“碱”)。
常温下弱电解质的电离平衡常数如下:氨水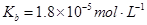
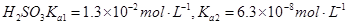
③向②中溶液中通入________气体可使溶液呈中性。(填“SO2”或NH3”)
此时溶液中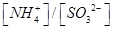 ________2(填“>”“<”或“=”)
________2(填“>”“<”或“=”)
(4)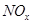 可用强碱溶液吸产生硝酸盐。在酸性条件下,FeSO4溶液能将
可用强碱溶液吸产生硝酸盐。在酸性条件下,FeSO4溶液能将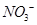 还原为NO,写出该过程中产生NO反应的离子方程式___________________________________。
还原为NO,写出该过程中产生NO反应的离子方程式___________________________________。
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。
它在碱性环境中稳定存在。
(1)NaClO2中Na、Cl、O原子半径由大到小的顺序为________________________,Cl元素在周期表中的位置为_______________________。
(2)NaClO2变质可分解为NaClO3和NaCl。分别取等质量未变质和部分变质的NaClO2试样配成溶液,与足量FeSO4溶液反应,消耗Fe2+的物质的量_____________(填相同、不相同)。
(3)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaC1O2+4HCI= 5NaCl+4C1O2↑+2H2O该反应中氧化剂和还原剂的物质的量之比是___________。
(4)常温时,HCIO2的电离平衡常数Ka=1.07×10-2 mol·L-1。
①NaClO2溶液中离子浓度大小顺序为__________________________________。
②常温时,l00mL 0.0lmol/L HClO2溶液与l0mL 0.1mol/L HClO2溶液相比,下列数值前者大于后者的有_ ________________,
| A.ClO2-的物质的量 | B.c(OH -) | C.电离平衡常数 | D.c(HClO2) |
③NaClO2溶液(含少量NaOH)的pH=13,则溶液中 =___________。
=___________。
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验编号 |
HA物质的量浓度 (mol·L-1) |
NaOH物质的量浓度 (mol·L-1) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2 ____(选填“是”或“否”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是_________________。
(3)丙组实验结果分析,HA是 酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是 。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。写出该混合溶液中下列算式的精确结果(不需做近似计算)。
c(Na+)-c(A-)= mol·L-1 c(OH-)-c(HA)= mol·L-1。
【原创】据中国地震台网测定,3月30日在贵州省黔东南苗族侗族自治州发生5.5级地震,据了解,这已经是贵州这个月以来发生的第三次地震。饮用水安全在灾后重建中占有极为重要的地位,为防止灾后疫病使用了大量的各种消毒液,如NaClO溶液,为防止灾后疫病使用了大量的各种消毒液,如NaClO溶液,某学习小组对消毒液次氯酸钠(NaClO)的制备与性质进行研究。
(1)下面是某同学从超市购买的某品牌消毒液包装说明查询到的部分内容:主要有效成分为次氯酸钠,有效氯含量8 000~ 10 000 mg/L。可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用。本品须密封,置阴凉暗处保存。据此分析:
①室温时,他测得该消毒液(NaClO)的pH_______7(填“>”、“=”或“<”),其原因为(用离子方程式表示)_________________________。
②该消毒液还具有的化学性质有____(填序号)
| A.强氧化性 | B.强还原性 | C.不稳定性 | D.漂白性 |
③从该消毒液的保存要求分析,导致其失效的主要原因是(用化学方程式表示)_________________。
④日常生活中也常用明矾作净水剂,用离子方程式表示其净水原理___________________。
(2)该学习小组同学用石墨和饱和食盐水设计了如图所示的装置,进行消毒液( NaClO 溶液)制备,通电时,电解饱和食盐水的化学方程式为_________________;为使生成的Cl2完全被吸收,则电源的a极应为___极(填“正”或“负”),溶液中生成NaClO的离子方程式为____________________。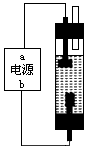
(1)向氯化铁溶液中加入碳酸氢钠溶液,发现有红褐色沉淀生成,并产生无色气体,其离子方程式为 。
(2)向盛有1mL 0.1mol/L MgCl2溶液的试管中滴加2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置。可以观察到白色沉淀转变为红褐色沉淀。简述产生该现象的原因: 。
(3)常温下,如果取0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,求出混合液中下列算式的精确计算结果(填具体数字): c(OH-)-c(HA)= mol/L。
(4)已知25℃时,AgCl的溶解度为1.435×10-4g,则该温度下AgCl的溶度积常数
Ksp= mol2/L2。
电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
| 化学式 |
电离常数(25℃) |
| HCN |
K=4.9×10-10 |
| CH3COOH |
K=1.8×10-5 |
| H2CO3 |
K1=4.3×10-7、K2=5.6×10-11 |
(5)25℃时,有等物质的量浓度的A. Na2CO3溶液、B. NaCN溶液、C.CH3COONa溶液,三溶液的pH由大到小的顺序为 。(用字母表示)
(6)向NaCN溶液中通入少量CO2,所发生反应的化学方程式为 。
次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性。回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式_______________________。
(2)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①H3PO2中,P元素的化合价为__________;
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为___________(填化学式);
③NaH2PO2为___________(填“正盐”或“酸式盐”),其溶液显___ ____(填“弱酸性”、“中性”或“弱碱性”)。
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应,写出白磷与Ba(OH)2溶液反应的化学方程式______________________。
(4)H3PO2也可用电渗析法制备。“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):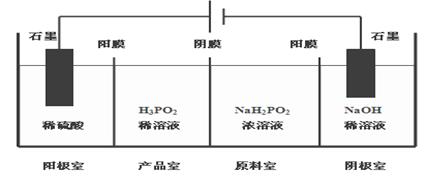
①写出阳极的电极反应式_________________ ___________________;
②分析产品室可得到H3PO2的原因__________________ _________________;
③早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有 杂质,该杂质产生的原因是 。
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)COCl2的分解反应为COCl2(g) Cl2(g)+CO(g)ΔH="+108" kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如图所示(第10 min到14 min的COCl2浓度变化曲线未示出):
Cl2(g)+CO(g)ΔH="+108" kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如图所示(第10 min到14 min的COCl2浓度变化曲线未示出):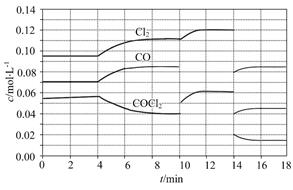
①计算反应在第8 min时的平衡常数K= ;
②比较第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2) T(8)(填“<”、“>”或“=”);
③若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)= mol·L-1;
④比较产物CO在2 min~3 min、5 min~6 min和12 min~13 min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)、v(12~13)表示]的大小 ;
⑤比较反应物COCl2在5 min~6 min和15 min~16 min时平均反应速率的大小:v(5~6) v(15~16)(填“<”、“>”或“=”),原因是 。
(2)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH-浓度与0.1mol·L-1NaOH溶液中由水电离出的OH-浓度之比为 ;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断 (NH4)2CO3溶液的pH 7(填“<”、“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为(填序号) 。
a、NH4HCO3 b、NH4A c、(NH4)2CO3 d、NH4Cl
“2015.8.12”天津港爆炸中有一定量的氰化物泄露。氰化物多数易溶于水,有剧毒,易造成水污染。已知部分弱酸的电离平衡常数如下表:
| 弱酸 |
HCOOH |
HCN |
H2CO3 |
| 电离平衡常数 ( 25℃) |
Ki=1.77×10-4 |
Ki=5.0×10-10 |
Ki1=4.3×10-7 Ki2=5.6×10-11 |
(1)根据价键规则,写出HCN的结构式是 ;
(2)下列能用于判断氮、碳两种元素非金属性强弱的是________。(填序号)
a.气态氢化物沸点
b.最高价氧化物对应水化物酸性强弱
c.Al2O3 + N2 + 3C ="=" 2AlN + 3CO
d.单质晶体类型
(3)一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是 ;通过列式计算“c(CN-)与c(HCN)”的大小 判断:c(CN-) c(HCN)(填“>”、“<”或“=”)
(4)含CN﹣的污水危害很大,处理该污水时,可在催化剂TiO2作用下用NaClO将CN﹣氧化成CNO﹣。CNO﹣在酸性条件下继续被NaClO氧化生成N2与CO2.某环保部门用下图装置进行实验,以证明该处理方法的有效性并测定CN﹣被处理的百分率。
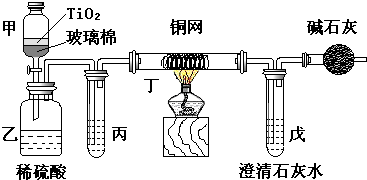
将浓缩后含CN﹣的废水与过量NaClO溶液的混合液(其中CN﹣浓度为0.05mol/L)200mL倒入甲中,塞上橡皮塞,一段时间后,打开活塞,使溶液全部放入乙中,关闭活塞。
①甲中反应的离子方程式为 ;乙中反应的离子方程式为 。
②乙中生成的气体除CO2、N2外还有HCl及副反应生成的Cl2等,上述实验是通过测定CO2的量来确定CN﹣的处理效果.丙中加入的除杂试剂是 (填标号)。
(A)饱和食盐 (B)饱和NaHCO3溶液 (C)浓NaOH溶液 (D)浓硫酸
丁在实验中的作用是 。戊中盛有足量的石灰水,若实验后戊中共生成0.8g沉淀,则该实验中CN﹣被处理的百分率 80%(填“>”、“二”或“<”=)。
Ⅰ.CO可用于合成甲醇。在压强为0.1MPa条件下,在体积为bL的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:
CO(g)+2H2(g) CH3OH(g)平衡时CO的转化率与温度、压强的关系如下图:
CH3OH(g)平衡时CO的转化率与温度、压强的关系如下图:
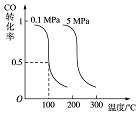
(1)该反应属于 反应(填“吸热”或“放热”)。
(2)100℃时,该反应的平衡常数:K= (用a、b 的代数式表示)。
(3)在温度和容积不变的情况下,再向平衡体系中充入a mol CO,2a mol H2,达到平衡时CO转化率 (填“增大”“不变”或“减小”)
Ⅱ.T ℃时,纯水中c(OH-)为10-6 mol·L-1,则该温度时
(1)将pH=3 的H2SO4溶液与pH=10的NaOH溶液按体积比9:2 混合,所得混合溶液的pH为 。
(2)若1体积pH1=a的某强酸溶液与10体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 。
Ⅲ. 在25mL的氢氧化钠溶液中逐滴加入0.2 mol/ L醋酸溶液,滴定曲线如图所示。

(1)该氢氧化钠溶液浓度为________________。
(2)在B点,a_________12.5 mL(填“<”“>”或“=”)。若由体积相等的氢氧化钠溶液和醋酸溶液混合且恰好呈中性,则混合前c(NaOH) c(CH3COOH)
(3)在D点,溶液中离子浓度大小关系为_____________________。
(1) 一定温度下,向1 L 0.l mol·L-1 CH3 COOH溶液中加入0.1 molCH3COONa固体,溶液中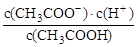 (填“增大”、“减小”或“不变”)。
(填“增大”、“减小”或“不变”)。
(2)常温下,将VmL、0.1000mol·L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol·L-1醋酸溶液中,充分反应。回答下列问题。(忽略溶液体积的变化)
①如果溶液pH=7,此时V的取值__ ___20.00(填“>”、“<”或“=”),而溶液中 c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为___________________。
②如果V=40.00,则此时溶液中c(OH-) -c(H+) - c(CH3COOH)=___________mol·L-1。
(3)常温下,向20 ml 0.1mol·L-1 Na2CO3溶液中逐滴加入0.1mol·L-1 HC1溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下图,回答下列问题:
①若将Na2CO3和NaHCO3混合物配成溶液,则此溶液的pH的取值范围是 ;
为测定Na2CO3和NaHCO3混合物中的质量分数,下列方案可行的是
| A.取a克混合物充分加热,减重b克 |
| B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体 |
| C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克 |
| D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体 |
②所得溶液中含量最多的三种离子的物质的量浓度的大小关系为
Ⅰ.在含有弱电解质的溶液中,往往有多个化学平衡共存。一定温度下,向1 L 0.l mol·L-1 CH3 COOH溶液中加入少量CH3COONa固体。
(1)CH3COOH溶液的电离平衡 移动(填“向左”、“向右”或“不”),溶液中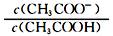 (填“增大”、“减小”或“不变”);
(填“增大”、“减小”或“不变”);
(2)若该溶液呈酸性,则溶液中各离子浓度由大到小的顺序为: 。
Ⅱ、开发新能源和三废处理都是可持续发展的重要方面。
(1)H2、CO、CH3OH都是重要能源物质,它们燃烧热依次为285.8KJ/mol、281.5KJ/mol、726.7KJ/mol.已知CO、H2在一定条件下可以合成甲醇CO(g)+2H2(g)=CH3OH(l)。则该合成甲醇的热化学方程式为
(2)CO在催化剂作用下可以与H2反应生成甲醇:
CO(g)+2H2(g) CH3OH(g)。在密闭容器中充入10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。在密闭容器中充入10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。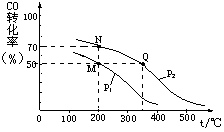
则M、N、Q三点的平衡常数KM、KN、KQ的大小关系为 ;P1 P2(填“>”或“<”或“=”);
M、N两点平衡状态下,容器中物质的总物质的量之比为:n(M)总:n(N)总= 。
(本题12分)
氮是地球上含量丰富的一种元素,合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重要影响。铵盐在工农业生产、生活中有着重大作用。 完成下列填空
完成下列填空
(1).在固定体积的密闭容器中,进行如下放热反应:N2(g)+3H2(g) 2NH3(g),其平衡常数K与温度T的关系如下表。
| T/K |
298 |
398 |
498 |
…… |
| 平衡常数K |
4.1×106 |
K1 |
K2 |
…… |
则该反应的平衡常数K1________K2 (填“>”、“<”或“=”)。
(2).能说明该反应已达到平衡状态的是________(填序号)。
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。
请回答下列问题:
(3).相同条件下,0.1 mol·L-1 NH4Al(SO4)2中c(NH4+)________(填“等于”“大于”或“小于”)0.1 mol·L-1 NH4HSO4中的c(NH4+)。
(4).如图所示是0.1 mol·L-1电解质溶液的pH随温度变化的图像。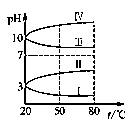
①其中符合0.1 mol·L-1 NH4Al(SO4)2溶液的pH随温度变化的曲线是________(填写序号),
导致pH随温度变化的原因是_______________________________;
②20℃时,0.1 mol·L-1 NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=__________。
(5).室温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示。
试分析图中a、b、c、d四个点,水的电离程度最大是________点;在b点,溶液中各离子浓度由大到小的排列顺序是______________。
雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):

(1)装置Ⅰ中的主要离子方程式为 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。
①若是0.1molNaOH反应后的溶液,测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是 。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)写出装置Ⅱ中,酸性条件下反应的离子方程 式 , 。
(4)装置Ⅲ还可以使Ce4+再生,其原理如图所示。①生成Ce4+从电解槽的 (填字母序号)口流出。②写出阴极的反应式 。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)
氮元素的化合物在工农业以及国防科技中用途广泛,但也会对环境造成污染,如地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。
完成下列填空:
(1)某课题组模拟地下水脱氮过程,利用Fe粉和KNO3(aq)反应探究脱氮原理。实验前
①用0.1mol·L-1H2SO4(aq)洗涤Fe粉,其目的是 ,然后用蒸馏水洗涤至中性;
②将KNO3(aq)的pH调至2.5;
③为防止空气中的 (写化学式)对脱氮的影响,应向KNO3溶液中通入N2。
(2)用足量Fe粉还原上述KNO3(aq)过程中,反应物与生成物的离子浓度、pH随时间的变化关系如图所示。请根据图中信息写出t1时刻前该反应的离子方程式: 。
(3)神舟载人飞船的火箭推进器中常用肼(N2H4)作燃料。NH3与NaClO反应可得到肼(N2H4),该反应中被氧化与被还原的元素的原子个数之比为 。如果反应中有5mol电子发生转移,可得到肼 g。
(4)常温下向25mL 0.01mol/L稀盐酸中缓缓通入5.6 mL NH3(标准状况,溶液体积变化忽略不计),反应后溶液中离子浓度由大到小的顺序是 。在通入NH3的过程中溶液的导电能力 (填写“变大”、“变小”或“几乎不变”)。
(5)向上述溶液中继续通入NH3,该过程中离子浓度大小关系可能正确的是 (选填编号)。
a.c(Cl-)=c(NH4+)>c(H+)=c(OH-) b.c(Cl-)>c(NH4+)=c(H+)>c(OH-)
c.c(NH4+)>c(OH-)>c(Cl-)>c(H+) d.c(OH-)>c(NH4+)>c(H+)>c(Cl-)
(6)常温下向25mL含HCl 0.01mol的溶液中滴加氨水至过量,该过程中水的电离平衡 (填写电离平衡移动情况)。当滴加氨水到25mL时,测得溶液中水的电离度最大,则氨水的浓度为 mol·L-1。
试题篮
()