(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“>”或“=”或“<”)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,溶液中
c(Na+) c(CH3COO-)(填“>”或“=”或“<”)
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积。(填“>”或“=”或“<”)
(1)CuSO4的水溶液呈 (填“酸”、“中”、“碱”) 性,常温时的pH 7(填“>”或“=”或“<”),实验室在配制CuSO4的溶液时,常将CuSO4固体先溶于硫酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)泡沫灭火器中的主要成分是Al2(SO4)3和NaHCO3溶液,反应的离子方程式为 。
把NH4Cl晶体溶入水中,得到饱和NH4Cl溶液。若在该溶液中加入镁条, 观察到有产生,点燃有爆鸣声,此气体是 ,产生该气体的原因是 (用离子方程式表示),微热后,能放出有刺激性气味的气体,它能使湿润的红色石蕊试纸变蓝,该气体是 ,产生该气体的原因是 ,总的离子反应方程式为 。
(1)等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”),溶液中c(Na+) c(CH3COO-)(填“>”或“=”或“<”)。
(2)某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH—)= mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中c(OH-)= mol/L,由水电离产生的c(H+)= mol/L,此时温度 25℃(填“高于”、“低于”或“等于”)。
(本题共13分)
氨气是重要的化工原料,工业上利用N2和H2合成NH3,方程式如下:N2 +3H2 2NH3
2NH3
29.已知NH3难溶于CCl4,则下列装置中,不能用于吸收氨气的是
30.某温度下,在一体积恒定为10L的密闭容器内模拟合成氨反应。若开始时充入:0.1mol N2、0.1mol H2和0.2mol NH3,则此时
 (填“>”或“<”或“=”,已知该温度下,平衡常数K值为
(填“>”或“<”或“=”,已知该温度下,平衡常数K值为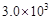 )。
)。
若要增大反应速率,且平衡向正反应方向移动,下列措施中可行的是 (填字母代号)。
A.压缩容器体积 B.适当升高温度
C.通入适量氮气 D.加适量催化剂
31.能说明上述反应达到平衡状态的是
A.2υ (H2) 3υ(NH3)
3υ(NH3)
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.单位时间内生成n mol N2的同时生成2n mol NH3
32.氨气溶于水所得溶液在加水稀释的过程中(本小题填“增大”或“减小”或“不变”),NH3·H2O的电离程度 ,电离平衡常数 ,溶液的pH值 。
33.氨气与酸反应得到铵盐,某(NH4)2SO4水溶液的pH=5,原因是溶液中存在平衡 (用离子方程式表示),该稀溶液中水的电离度约为 。
(6分)复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1 mol·L-1的下列6种溶液的pH值:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O。
依照该规律,请判断下列反应不能成立的是 (填编号)。
A.CO2+H2O+2NaClO===Na2CO3+2HClO
B.CH3COOH+NaCN===CH3COONa+HCN
C.CO2 +H2O +C6H5ONa NaHCO3+C6H5OH
NaHCO3+C6H5OH
D.CO2 +H2O +2C6H5ONa Na2CO3+2C6H5OH
Na2CO3+2C6H5OH
(2)根据前述信息判断,常温下,浓度均为0.05 mol·L-1的下列5种物质的溶液中,pH最小的是 (填编号),其pH值约为 (填数值)。
①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
(12分)已知二元酸H2A在水中存在以下电离:H2A===H++HA-,HA-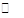 H++A2-。试回答下列问题:
H++A2-。试回答下列问题:
(1)NaHA溶液呈__ _(填“酸”“碱”或“中”)性,理由是 。
(2)某温度下,向10 mL、0.1 mol·L-1 NaHA溶液中加入0.1 mol·L-1 KOH溶液V mL至中性,此时溶液中以下关系一定正确的是 (填字母)。
| A.溶液pH=7 | B.水的离子积Kw=c2(OH-) |
| C.V>10 | D.c(K+) =c(Na+) |
(3)已知难溶物CaA在水中存在溶解平衡:CaA(s)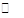 Ca2+(aq)+A2-(aq) ΔH>0。一定温度下向浊液中通入HCl气体,c(Ca2+) (填“减小”、“增大”或“不变”),原因是 。
Ca2+(aq)+A2-(aq) ΔH>0。一定温度下向浊液中通入HCl气体,c(Ca2+) (填“减小”、“增大”或“不变”),原因是 。
(4)测得25℃时,CaA的Ksp为2.0×10-11。常温下将10gCaA固体投入110mLCaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.08 mol·L-1,则溶液中c(A2-)= 。
(1)AgNO3的水溶液呈 (填“酸”“中”或“碱”)性,原因是(用离子方程式表示): ;实验室在配制AgNO3溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”或“抑制”)其水解。
(2)明矾溶于水其中铝离子水解可用于净水,用离子方程式表示:
(3)纯碱可代替洗涤剂洗涤餐具,原因是(用离子方程式表示):
现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵,⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) 。
(2)④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号) 。
(3)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是 。
(4)已知t℃,KW=1×10-13,在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b= 。
(8分)常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 0.1000 mol/L HCl溶液和
20.00 mL 0.1000 mol/L CH3COOH溶液,得到2条滴定曲线,如下图所示:
(1)由A、C点判断,滴定HCl溶液的曲线是______(填“图1”或“图2”);
(2)a=________ mL;
(3)c(Na+)=c(CH3COO-)的点是________;
(4)E点对应离子浓度由大到小的顺序为________________。
常温下,有下列7种溶液:A.Na2CO3 B.CH3COONa C.AlCl3
D.CH3COOH E.NaHCO3 F.NaOH G.HCl。
请回答有关问题:
(1)A溶液显碱性的离子方程式是: ;
(2)将C溶液蒸干灼烧后得到的固体是(写化学式): ;C与E是“泡沫灭火器”的药品,写出两溶液混合反应的离子方程式: ;
(3)若A、E两种溶液的pH相同,物质的量浓度大小关系是 。
(4)A、B、F溶液各25mL、物质的量浓度均为0.1mol/L,若分别加入25mL 0.1mol/L 的G溶液后,pH最大的是: 。(填“A、B或F”)
(10分)物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为________。
(2)B为0.1 mol·L-1NaHCO3溶液,实验测得NaHCO3溶液的pH>7,请分析NaHCO3溶液显碱性的原因:_______________________________________。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入________,目的是_______________;
若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为________________。
写出下列电解质在水溶液中的电离方程式
(1)Ca(HCO3)2:_____________________________;
(2)H2SO3:_____________________________;
写出下列电解质在水溶液中的水解离子方程式
(3)CH3COONa:_____________________________;
(4)Fe2(SO4)3:_____________________________。
(11分)(1)常温下,0.10 mol·L-1 NH4Cl溶液pH______7(填“>”、“=”或“<”)。
(2)相同物质的量浓度的Na2CO3溶液与NaHCO3溶液,pH大小:Na2CO3________NaHCO3(填“>”、“=”或“<”)。
(3)在配制FeCl3溶液时,应加入__________,目的是_____________。
(4)Na2S溶液中滴入酚酞溶液显______色,原因是__________________。(用离子方程式表示),
(5)将氯化铝溶液蒸干并灼烧得到的固体物质是 ;(填化学式,下同)将硫酸铝溶液蒸干得到的固体物质是 。
试题篮
()