25 ℃时,将0.01 mol CH3COONa和0.002 mol HCl溶于水,形成1 L混合溶液。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
① ;
② ;
③ 。
(2)溶液中共有 种不同的粒子(指分子和离子)。
(3)在这些粒子中,浓度为0.01 mol·L-1的是 ,浓度为0.002 mol·L-1的是 。
(4) 和 两种粒子物质的量之和等于0.01 mol。
铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
| |
Fe3+ |
Fe2+ |
Cu2+ |
| 氢氧化物开始沉淀时的pH |
1.9 |
7.0 |
4.7 |
| 氢氧化物完全沉淀时的pH |
3.2 |
9.0 |
6.7 |
请回答下列问题:
(1)加入氧化剂的目的是 。
(2)最适合作氧化剂X的是 。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)加入的物质Y是 。
(4)若不用物质Y而是直接用碱能不能达到目的? (填“能”或“不能”)。若不能,试解释原因 。
(5)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体? (填“能”或“不能”)。若能,不用回答;若不能,回答该如何操作? 。
(6)若向溶液Ⅱ中加入碳酸钙,产生的现象是 。
已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(NH4+)>c(OH-)>c(Cl-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解一种溶质,则该溶质是 ,上述四种离子浓度的大小顺序为(填序号)________________。
(2)若四种离子的关系符合③,则溶质为 ;若四种离子的关系符合④,则溶质为 。
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,则下面图象正确的是(填图象符号)________。
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)________c(NH3·H2O)(填“大于”“小于”或“等于”)。
计算多元弱酸(HnX)溶液的c(H+)及比较弱酸的相对强弱时,通常只考虑第一步电离。回答下列关于多元弱酸HnX的问题。
(1)若要使HnX溶液中c(H+)/c(HnX)增大,可以采取的措施是 。
A.升高温度 B.加少量固态HnX C.加少量NaOH溶液 D.加水
(2)用离子方程式解释NanX呈碱性的原因: 。
(3)若HnX为H2C2O4,且某温度下,H2C2O4的K1=5×10-2、K2=5×10-5.则该温度下,0.2mol/L H2C2O4溶液 中c(H+)约为 mol/L。(已知
 )
)
(4)已知KHC2O4溶液呈酸性。
①KHC2O4溶液中,各离子浓度由大到小的顺序是 。
②在KHC2O4溶液中,各粒子浓度关系正确的是 。
A.c(C2O42-)<c(H2C2O4)
B.c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
C.c(K+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-)
D.c(K+)= c(C2O42-)+ c(HC2O4-)+ c(H2C2O4)
在25mL 0.1 mol·L-1的NaOH溶液中逐滴加入0.2 mol·L-1的CH3COOH溶液,溶液pH变化曲线如图所示。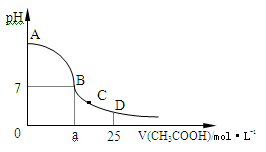
(1)B点溶液呈中性,有人据此认为,在B点时NaOH溶液与CH3COOH溶液恰好完全反应,这种看法是否正确? (填“是”或“否”),如果不正确,则二者恰好完全反应的点是在 (填“AB”、“BC”或“CD”)区间内。
(2)在D点时,溶液中c(CH3COO-)+c(CH3COOH) 2c(Na+)(填“>”、“<”或“=”)。
(3)在C点,溶液中离子浓度由大到小的顺序为: 。
(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,实验室在配制AgNO3溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,浓的硝酸以 (填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈 性 ,原因是________________;(用离子方程式表示):
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 _______ 。(用化学式表示)
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少的 ____。原因是: ______________(用离子方程式表示) 。
(4)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀 (填化学式),生成该沉淀的离子方程式为 。
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20)
(14分)25℃时0.1 mol/L的醋酸溶液的pH约为3,当向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大.对上述现象有两种不同的解释:
甲认为:醋酸钠水解呈碱性,c(OH-)增大了,因而溶液的pH增大;
乙认为:醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大.
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1 mol/L的醋酸溶液中加入少量下列物质中的________(填写编号),然后测定溶液的pH.(已知25℃时,CH3COONH4溶液呈中性).
| A.固体CH3COOK | B.固体CH3COONH4 |
| C.气体NH3 | D.固体NaHCO3 |
(2)加入(1)中物质后,若甲的解释正确,溶液的pH应________;若乙的解释正确,溶液的pH应________;(填“增大”“减小”或“不变”).
(3)常温下将0.010 mol CH3COONa和0.004 mol HCl溶于水,配制成0.5 L混合溶液.判断:
①溶液中共有________种粒子;
②其中有两种粒子的物质的量之和一定等于0.010 mol,它们是________和________;
③溶液中n(CH3COO-)+n(OH-)-n(H+)=________mol.
(6分)(1)硫化钠水溶液显碱性的原因_______________(用离子方程式表示)
(2)用硫化亚铁作沉淀剂除去污水中的Cu2+_______________________
(3)浑浊的石灰水中存在的溶解平衡________________
(6分)根据下列事实,完成相关的离子方程式或电离方程式
(1)Na2S溶液使酚酞显红色
(2)硫酸铝钾[明矾KAl(SO4)2·12H2O]可以作净水剂
(3)常温下,磷酸(H3PO4)溶液pH﹤7
在氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其溶于水后加少量盐酸配制成水溶液,然后按下图所示的操作步骤进行提纯。
已知Cu2+、Fe2+在pH=4~5时不水解,而Fe3+几乎完全水解而沉淀。
(1)加入氧化剂的目的_______________;
(2)下列物质都可以作为氧化剂,其中最适合本实验的是_____;
| A.H2O2 | B.KMnO4 | C.NaClO | D.K2Cr2O7 |
(3)物质Y是_________,加入Y的目的______________,沉淀E是_______________;
(4)欲将CuCl2•2H2O加热制得无水CuCl2,要采用什么方法和措施?_______________________
(10分)按要求完成以下内容:
(1)Fe2(SO4)3水溶液呈________性,原因是(用离子方程式表示):_________________________;实验室在配制Fe2(SO4)3溶液时,需要加入________来抑制水解。
(2)有三瓶pH均为2的盐酸、硫酸溶液、醋酸溶液。
①设三种溶液的物质的量浓度依次为c1、c2、c3,则它们之间由小到大的顺序为______(用“>”“<”或“=”表示,下同)。
②取同体积的三种酸溶液,分别加入足量锌,反应开始产生H2的速率依次为v1、v2、v3,则它们之间的关系是_____________________;
(3)某温度下,水的离子积常数KW=10-14。该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为____________。
(本题共10分)现有25 ℃时,0.1 mol/L的氨水。请回答下列问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中 ________(填“增大”、“减小”或“不变”)。
________(填“增大”、“减小”或“不变”)。
(2)若向氨水中加入稀硫酸,使其恰好完全中和,写出反应的离子方程式:____________________;所得溶液的pH________7(填“<”、“>”或“=”),用离子方程式表示其原因:_______________。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol/L,则c(SO42-)=____________。
(4)若向氨水中加入pH=1的硫酸溶液,且氨水与硫酸溶液的体积比为1∶1,则所得溶液中各离子物质的量浓度由大到小的顺序是___________________________________。
(6分)复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1 mol·L-1的下列6种溶液的pH值:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O。
依照该规律,请判断下列反应不能成立的是 (填编号)。
A.CO2+H2O+2NaClO===Na2CO3+2HClO
B.CH3COOH+NaCN===CH3COONa+HCN
C.CO2 +H2O +C6H5ONa NaHCO3+C6H5OH
NaHCO3+C6H5OH
D.CO2 +H2O +2C6H5ONa Na2CO3+2C6H5OH
Na2CO3+2C6H5OH
(2)根据前述信息判断,常温下,浓度均为0.05 mol·L-1的下列5种物质的溶液中,pH最小的是 (填编号),其pH值约为 (填数值)。
①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
填写下列空格:
(1)草木灰(含K2CO3)显碱性的原因是(用离子方程式表示) ,所以 (填“能”或“不能”)与铵态氮肥混合施用。
(2)室温下pH=9的NaOH溶液中,由水电离产生的c(OH-)为 mol/L;把0.1mol/L HCl与0.3mol/L的NaOH溶液等体积混合,所得溶液的pH= 。
(3)3mol/L 100mL H2SO4溶液与足量的Zn反应,为使产生的H2速率减慢,但产生的H2的总量不变,可采取的措施______(填下列选项的序号)
| A.加醋酸钠固体 | B.加NH4Cl溶液 | C.加BaCl2溶液 | D.加氨水 |
(4)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 。(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)
试题篮
()