(1)25℃时,在0.10mol/L的氨水中逐滴加入同浓度的盐酸(不计两者的挥发性),回答下列问题:
①当溶液pH=7时,溶液中c(NH4+) c(Cl-)(用“<”、“>”、“=”填空,下同);
②当盐酸和氨水溶液恰好中和时,溶液中c(H+) c(OH-);
(2)某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路。某实验小组的同学对该厂生产的印刷电路后所得的废液进行了分析:取50mL废液,向其中加入足量的稀硝酸,生成0.02molNO;另取50mL废液,向其中加入足量的AgNO3溶液,析出沉淀43.05g。
请回答以下问题:
①该厂原来使用的FeCl3溶液中溶质的物质的量浓度为_____(反应前后溶液的体积变化忽略不计);
②废液中各金属阳离子的物质的量浓度之比为C(Fe3+):C(Fe2+):C(Cu2+)=__________;
③另取50mL废液,加入一定量铁屑,充分反应后有铜析出,则所得溶液中Fe2+的物质的量范围是 。
在氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其溶于水后加少量盐酸配制成水溶液,然后按下图所示的操作步骤进行提纯。
已知Cu2+、Fe2+在pH=4~5时不水解,而Fe3+几乎完全水解而沉淀。
(1)加入氧化剂的目的_______________;
(2)下列物质都可以作为氧化剂,其中最适合本实验的是_____;
| A.H2O2 | B.KMnO4 | C.NaClO | D.K2Cr2O7 |
(3)物质Y是_________,加入Y的目的______________,沉淀E是_______________;
(4)欲将CuCl2•2H2O加热制得无水CuCl2,要采用什么方法和措施?_______________________
(10分)
(1)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应正极电极反应式为_______;放电时,CO32-移向电池的______(填“正”或“负”)极。
(2)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
(3)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液c(H2CO3)______c(CO32-)(填“>”、“=”或“<”),原因是__________(用离子方程式和必要的文字说明)。
(6分)完成下列离子反应方程式
(1)AlCl3溶液与Na2CO3溶液混合:______________;
(2)向AgCl固体上滴加Na2S溶液,固体变黑色:_________________;
(3)铁在潮湿的空气中发生电化腐蚀时,正极反应式:_________________。
现有下列电解质溶液:
①Na2CO3 ②NaHCO3 ③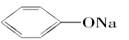 ④CH3COONH4 ⑤NH4HCO3
④CH3COONH4 ⑤NH4HCO3
(1)在这五种电解质溶液中,既能与盐酸又能与烧碱溶液反应的是(填写序号)________。
(2)已知酸性:H2CO3>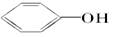 >
>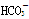 。常温下,物质的量浓度相同的①②③溶液,pH由大到小顺序为(填序号)________>________>________。
。常温下,物质的量浓度相同的①②③溶液,pH由大到小顺序为(填序号)________>________>________。
(3)写出⑤与足量NaOH溶液混合加热反应的离子方程式: __________________________________________________________________。
(4)已知常温下CH3COONH4溶液呈中性,根据这一事实推测⑤溶液的pH________7(填“>”“=”或“<”),理由是________________________。
请写出下列溶液水解(或双水解)的离子反应方程式:
(1)次氯酸钠溶液:
(2)硫酸铵溶液:
(3)明矾净水原理:
(4)泡沫灭火器工作原理:
(5) 氯化铁溶液与偏铝酸钾溶液混合:
现有常温下的六份溶液:
①0.01 mol/L CH3COOH溶液;
②0.01 mol/L HCl溶液;
③pH=12的氨水;
④pH=12的NaOH溶液;
⑤0.01 mol/L CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;
⑥0.01 mol/L HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是_______(填序号,下同),水的电离程度相同的是__________。
(2)若将②、③混合后所得溶液pH=7,则消耗溶液的体积:②___③(填“>”,“<”或“=”)
(3)将六份溶液同等稀释10倍后,溶液的pH:
①________②,③________④,⑤________⑥(填“>”、“<”或“=”)。
(4)将①、④混合,若有c(CH3COO-)>c(H+),则混合溶液可能呈________(填序号)。
A.酸性 B.碱性 C.中性
常温下有浓度均为0.05 mol/L的四种溶液:①Na2CO3 ②NaHCO3③HCl ④NH3·H2O,回答相关问题:(1)上述溶液中,可发生水解的是 (填序号)
(2)上述溶液中,既能与NaOH溶液反应,又能与H2SO4溶液反应的溶液中,离子浓度大小的关系
(3)向④中加入少量NH4Cl固体,此时c(NH4+/OH-)的值 (“增大”、“减小”或“不变” )
(4)若将③和④的溶液混合后,溶液恰好呈中性,则混合前③的体积 ④的体积(“大于”、 “小于”或“等于”)
(5)取10 mL的③溶液,加水稀释到500 mL,则此溶液中由水电离出的c(H+)= mol/L
(8分)已知在25 ℃时,醋酸、次氯酸、碳酸和亚硫酸的电离平衡常数分别为
醋酸 K=1.75×10-5 次氯酸 K=2.95×10-8
碳酸K1=4.30×10-7 K2=5.61×10-11 亚硫酸 K1=1.54×10-2 K2=1.02×10-7
(1)写出碳酸的第一级电离平衡常数表达式K1=__________。
(2)在相同条件下,等浓度的CH3COONa、NaClO、Na2CO3和Na2SO3溶液中碱性最强的是________。等浓度的Na2CO3和NaHCO3的混合溶液中各离子浓度大小顺序为 。
(3)若保持温度不变,在醋酸溶液中通入少量HCl,下列量会变小的是________。
a.c(CH3COO-) b.c(H+) c.醋酸的电离平衡常数
(4)下列离子方程式中错误的是________。
a.少量CO2通入次氯酸钠溶液中:CO2+H2O+ClO-===HCO3—+HClO
b.少量SO2通入次氯酸钙溶液中:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO
c.过量CO2通入澄清石灰水中:CO2+OH-=== HCO3—
(10分)按要求完成以下内容:
(1)Fe2(SO4)3水溶液呈________性,原因是(用离子方程式表示):_________________________;实验室在配制Fe2(SO4)3溶液时,需要加入________来抑制水解。
(2)有三瓶pH均为2的盐酸、硫酸溶液、醋酸溶液。
①设三种溶液的物质的量浓度依次为c1、c2、c3,则它们之间由小到大的顺序为______(用“>”“<”或“=”表示,下同)。
②取同体积的三种酸溶液,分别加入足量锌,反应开始产生H2的速率依次为v1、v2、v3,则它们之间的关系是_____________________;
(3)某温度下,水的离子积常数KW=10-14。该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为____________。
(1)将一定量氨气通入盐酸中,溶液pH恰好为7(25 ℃),则氨的物质的量_____(填“<”、“=”或“>”)盐酸中HCl的物质的量;溶液中c(NH4+)_____c(Cl-)。
(2)向同体积同物质的量浓度的盐酸和氯化铵溶液中加入等质量的镁粉,镁完全反应后,盐酸放出气体的体积_____氯化铵溶液放出气体的体积。
(3)向盐酸中通入NH3至恰好完全反应时,所得溶液由H2O电离出来的c(H+)比纯水电离出来的c(H+)_____(填“大”、“小”或“相等”)。
(1)要除去MgCl2酸性溶液里少量的Fe3+,可选用的试剂是 (填序号) 。
| A.MgO |
| B.MgCO3 |
| C.NaOH |
| D.Mg(OH)2 |
E.Fe(OH)3
(2)某温度下纯水中C(H+)=2×10-7 mol/L,则此时溶液中的C(OH-) = ;若温度不变,滴入稀盐酸使C(H+)=5×10-6 mol/L,则此时溶液中的C(OH-) = 。
(3)某温度下纯水的c(H+)=1.0×10-6 mol•L-1,在此温度下,将pH=8的Ba(OH)2与pH=5的稀盐酸混合,欲使pH=7,则Ba(OH) 2与稀盐酸的体积比为 。
在0.5 mol/L的NaHSO3溶液中滴入石蕊,溶液变红。试回答下列问题:
(1)该溶液中HSO3-的电离程度______(填“大于”、“小于”或“等于”)HSO3-的水解程度。
(2)溶液中Na+、HSO3-、H+、OH-、SO32-等离子的浓度由大到小的顺序为____________。
(3)在Na2SO3溶液中滴入酚酞,溶液变红。若在该溶液中再滴入过量的BaCl2溶液,所观察到的现象是__________________。
(本题共10分)现有25 ℃时,0.1 mol/L的氨水。请回答下列问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中 ________(填“增大”、“减小”或“不变”)。
________(填“增大”、“减小”或“不变”)。
(2)若向氨水中加入稀硫酸,使其恰好完全中和,写出反应的离子方程式:____________________;所得溶液的pH________7(填“<”、“>”或“=”),用离子方程式表示其原因:_______________。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol/L,则c(SO42-)=____________。
(4)若向氨水中加入pH=1的硫酸溶液,且氨水与硫酸溶液的体积比为1∶1,则所得溶液中各离子物质的量浓度由大到小的顺序是___________________________________。
试题篮
()