铁及其化合物在日常生活、生产中应用广泛。
(1)某温度下,Ksp(FeS)=8.1×10-17,FeS饱和溶液中c(H+)与c(S2-)之间存在关系:
c2(H+)·c(S2-)=1.0×10-22,为了使溶液里c(Fe2+)达到1 mol·L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的pH约为________(填字母)。
A.2 B.3 C.4 D.5
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆。以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下: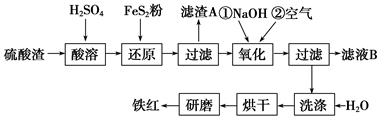
①酸溶过程中Fe2O3发生反应的离子方程式为_____________;“滤渣A”主要成分的化学式为_______________。
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式: FeS2+____Fe3++______===______Fe2++____SO42-+______
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为________________________。
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8。
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
| 开始沉淀pH |
2.7 |
3.8 |
7.6 |
9.4 |
| 完全沉淀pH |
3.2 |
5.2 |
9.7 |
12.4 |
如果pH过大,可能引起的后果是____________________(几种离子沉淀的pH见上表)。
⑤滤液B可以回收的物质有________(填序号)。
A.Na2SO4 B.Al2(SO4)3 C.Na2SiO3 D.MgSO4
试题篮
()