下列过程没有起到氮的固定作用的是
| A.N2与O2反应生成NO |
| B.NH3经催化氧化生成NO |
| C.N2和H2在一定条件下合成氨 |
| D.豆科植物的根瘤菌将空气中的氮气转化为含氮化合物 |
40mLNO、O2混合气体通入到足量的NaOH溶液中充分反应后,溶液中只有NaNO2和NaOH,若剩余气体5mL,则原混合气体中的NO体积为
| A.20mL | B.25mL | C.28mL | D.33mL |
最新研究表明:NO吸收治疗法可快速改善SARS重症患者的缺氧状况,缓解病情。病毒学研究同时证实,NO对SARS病毒有直接抑制作用。下列关于NO的叙述正确的是( )
| A.NO是一种红棕色的气体 |
| B.常温常压下,NO不能与空气中氧气直接化合 |
| C.含等质量的氧元素的NO和CO的物质的量相等 |
| D.NO易溶于水,不能用排水法收集 |
发射航天火箭常用氮的氢化物肼(N2H4)作燃料。试回答下列有关问题:
(1)N2H4燃烧时用NO2作氧化剂,它们相互反应生成氮气和水蒸气。
则N2H4和NO2反应生成氮气和水蒸气的热化学方程式为 。
(2)利用肼、氧气与KOH溶液组成碱性燃料电池,氮元素被氧化后只生成氮气,请写出该电池工作时负极的电极反应 ;电池工作时, 极pH升高。
(3)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的化学方程式 。
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。写出盐酸肼第一步水解反应的离子方程式 。
下列变化中不属于氮的固定的是
| A.豆科植物的根瘤菌把氮气变为NH3 |
| B.闪电时,空气中的O2和N2化合成NO |
| C.工业上将NH3与CO2在高温高压下制成[CO(NH2)2] |
| D.工业上用N2和H2合成NH3 |
下列变化中不属于氮的固定的是
| A.豆科植物的根瘤菌把氮气变为NH3 |
| B.闪电时,空气中的O2和N2化合成NO |
| C.工业上将NH3与CO2在高温高压下制成[CO(NH2)2] |
| D.工业上用N2和H2合成NH3 |
下列变化中不属于氮的固定的是
| A.豆科植物的根瘤菌把氮气变为NH3 |
| B.闪电时,空气中的O2和N2化合成NO |
| C.工业上将NH3与CO2在高温高压下制成[CO(NH2)2] |
| D.工业上用N2和H2合成NH3 |
.用仪器A、B和胶管组成装置收集NO气体(①仪器A已经气密性检查;②除水外不能选用其他试剂)。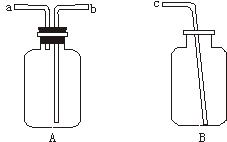
正确的操作步骤是_________________________________
硝酸被称为“国防工业之母”是因为它是制取炸药的重要原料。下列实验事实与硝酸性质不相对应的一组是( )
| A.浓硝酸使紫色石蕊试液先变红后褪色——酸性和强氧化性 |
| B.不能用稀硝酸与锌反应制氢气——强氧化性 |
| C.要用棕色瓶盛装浓硝酸——不稳定性 |
| D.能使滴有酚酞的氢氧化钠溶液红色褪去——强氧化性 |
常温下,在100ml 12mol·L—1的浓HNO3中加入足量的铁粉,最终产生标准状况下气体的体积为(不考虑NO2转化为N2O4)
| A.几乎无气体产生 | B.等于6.72L[来 |
| C.等于13.44L | D.介于6.72L至13.44L之间 |
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应的氧化剂是 ,其还原产物是 ;
(3)该反应产生标准状况下11.2升CO气体,则电子转移 摩尔。
(4)若有1摩尔焦炭与足量的SiO2、氮气反应,电子转移 (填大于、等于或小于)2摩尔,理由是 。
某化学实验小组,通过Li3N固体水解生成氢氧化锂和氨气的反应制氨气,并进行氨气还原氧化铜的实验探究。如下图所示,给出了本实验可供选择的装置:
请回答下列问题:
(1)按该方法制氨气时,应选用上述装置中的 (填装置代码,下同)做氨气发生装置。
(2)为检验氨气还原氧化铜反应后生成Cu、H2O、N2,氨气发生装置后应依次连接 → C → → →
(3)在C装置前后连接的装置中,填充的药品按前后顺序分别为 、 。
(4)有资料提出:CuO被还原时,当黑色固体完全变为红时,不一定完全转化为Cu,可能还含有Cu2O。已知查阅到一离子反应方程式:Cu2O+2H+=Cu2++Cu+H2O。依据该信息,若证明C处的红色固体中是否含有Cu2O ,请设计实验: 。
(5)实验时充分加热,至C装置质量不再减轻为止。实验完毕后,若实验测得收集的N2体积为aL(已折算为标准状况)。则若用CH4还原同样多CuO,理论上最少需要CH4的体积为(标准状况,用含字母a的代数式表示) L。
氨是最重要的氮肥原料。在课本里学到的合成氨技术叫哈伯法,近一个世纪,合成氨需要高温高压似乎是天经地义了。然而,最近有两位希腊化学家在《科学》杂志上发表文章说,在常压下把氢气和用氦气稀释的氮气分别通入一个加热到570℃的电解池(如图),氢气和氮气便可在电极上合成氨,转化率竟然高达78%。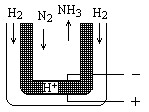
请根据以上材料回答下列问题:
(1)写出哈伯法合成氨的化学方程式: ;其反应条件中,符合平衡移动原理的反应条件是
(2)新法合成氨的电解池中能否用水溶液作电解质? (填“能”、“不能”)
为什么?
(3)电解池中,阳极发生 (填得或失)电子氧化反应,变价元素化合价 (填升高或降低)
(4)新法合成氨中所用的电解质(如图中黑细点所示)能传导H+,试写出电极反应式和总反应式。阳极: ;阴极___________________________
总反应式:__________________________________。
有关氨气的实验较多,下面对这些实验原理的分析中,正确的是
| A.氨气极易溶于水,可以用来做喷泉实验 |
| B.氨气的还原性可以解释氨气与氯化氢的反应实验 |
| C.NH3·H2O不稳定,实验室可用NH4Cl和石灰水制取氨气 |
| D.NH3液化时放出大量的热,因而,不能用氨作制冷剂 |
试题篮
()