氨气在工农业生产中有重要应用。
(1)①氮气用于工业合成氨,写出氮气的电子式 ;
②NH3的稳定性比PH3 (填写“强”或“弱”)。
(2)如下图所示,向NaOH固体上滴几滴浓氨水,迅速盖上盖,观察现象。
①浓盐酸液滴附近会出现白烟,发生反应的化学方程式为 。
②浓硫酸液滴上方没有明显现象,一段时间后浓硫酸的液滴中有白色固体,该固体可能是 (写化学式,一种即可)。
③FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应包括
Fe2++2NH3·H2O=Fe(OH)2↓+ 2NH4+ 和 。
(3)空气吹脱法是目前消除NH3对水体污染的重要方法。在一定条件下,向水体中加入适量NaOH可使NH3的脱除率增大,用平衡移动原理解释其原因 。
(4)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),反应的化学方程式为 ,若反应中有0.3 mol电子发生转移时,生成亚硝酸的质量为 g(小数点后保留两位有效数字)。
氮氧化物进入大气后,可能会形成硝酸型酸雨,因此必须对含有氮氧化物的废气进行处理。
(1)用NaOH可以吸收废气中的氮氧化物,反应的化学方程式如下:2NO2 + 2NaOH  NaNO2 + NaNO3 + H2O 反应中,还原剂是 ,NO2 + NO + 2NaOH
NaNO2 + NaNO3 + H2O 反应中,还原剂是 ,NO2 + NO + 2NaOH  2NaNO2 + H2O 反应中,氧化产物和还原产物之比为 。
2NaNO2 + H2O 反应中,氧化产物和还原产物之比为 。
(2)NO2和Br2蒸汽都是红棕色气体,下列可以用来鉴别这两种气体的试剂是 。
| A.用氢氧化钠溶液 | B.淀粉碘化钾溶液 | C.用硝酸银溶液 | D.用蒸馏水 |
(3)汽车尾气中含有一氧化氮和一氧化碳,消除这两种物质对大气污染的方法是安装催化转化器,使它们发生反应生成两种对大气无污染的气体,该反应的化学方程式为 。
(4)氨气也可用来处理氮氧化物,例如:氨气与二氧化氮反应生成氮气和水,写出该反应的化学方程式: ,若某工厂排出的废气中二氧化氮含量为0.5%(体积分数),处理1000m3(标准状况)这种废气,需要 千克氨气。(结果保留两位小数)
化学肥料在农业生产中具有重要的作用,关系着农业生产是否丰收。化学肥料在农业生产中的广泛应用,为化学肥料的大规模工业生产提供了舞台。
(1)在合成氨的设备(合成塔)中,设置热交换器的目的是______________。
(2)生产硝酸的过程中常会产生一些氮的氧化物,一般可采用下列两种方法处理。
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
氨还原法:8NH3+6NO2 7N2+12H2O(NO也有类似的反应)
7N2+12H2O(NO也有类似的反应)
请从绿色化学的角度分析两种方法的优劣:____________________。
(3)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%,NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗用NH3质量(不考虑其他损耗)的________%。
(4)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,把应注意的事项及理由填入下表(填两条应注意的事项及理由即可)。
| |
注意事项 |
理由 |
| ① |
______________ |
____________ |
| ② |
________________ |
____________ |
(Ⅰ)磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等。
(1)磷的某种核素中,中子数比质子数多1,则表示该核素的原子符号为____________。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2= 6CaSiO3+P4O10 10C+P4O10= P4↑+10CO↑
上述反应中的各种物质,属于酸性氧化物的有 。
(3)白磷有剧毒,不慎沾到皮肤上,可用CuSO4溶液冲洗解毒。白磷可与热的CuSO4溶液反应生成磷化亚铜,与冷溶液则析出铜,反应方程式分别(均未配平)为:
①P4+CuSO4+H2O→Cu3P+H3PO4+H2SO4
②P4+CuSO4+H2O→Cu+H3PO4+H2SO4
反应①中,氧化剂为 ,若上述两反应中被氧化的P4的物质的量相等,则消耗的CuSO4的物质的量之比为 。
(Ⅱ)离子交换膜是一类具有离子交换功能的高分子材料。一容器被离子交换膜分成左右两部分,如图所示。
若该交换膜为阳离子交换膜(只允许阳离子自由通过),左边充满盐酸酸化的H2O2溶液,右边充满滴有KSCN溶液的FeCl2溶液(足量),一段时间后右边可观察到的现象: ;若该交换膜为阴离子交换膜(只允许阴离子自由通过),左边充满含2mol NH4Al(SO4)2的溶液,右边充满含3mol Ba(OH)2的溶液,当有2mol SO42-通过交换膜时(若反应迅速完全),则左右两室沉淀的物质的量之比为 。
(Ⅲ)某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质,利用相关工艺可进行提纯与综合利用。通入一定量的N2后,在1500℃下与Cl2充分反应得到纯化石墨与气体混合物,然后降温至80℃,分别得到不同状态的两类物质a和b。(注:石墨中氧化物杂质均转变为相应的氯化物,SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃。)
(1)若a与过量的NaOH溶液反应,可得两种盐,其中一种盐的水溶液具有粘合性,
化学反应方程式为 _________。
(2)若b与过量的NaOH溶液充分反应后,过滤,所得滤液中阴离子有 _________。
某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。
可选药品:稀硝酸、浓硝酸、浓硫酸、NaOH溶液、蒸馏水
查阅资料:
A.浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。
B.氢氧化钠溶液不与NO反应,能与NO2反应2NO2 + 2NaOH = NaNO3 + NaNO2 +H2O
| 实验过程 |
实验现象 |
| I.检验装置的气密性 |
|
| II.…… |
|
| III.打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞。 |
①中产生大量的红棕色气体,红棕色气体在②中变为无色,气体通过③后依然为无色,通过④后变为红棕色 |
(1)①中发生反应的离子方程式是 。
(2)②中发生反应的化学方程式是 。
(3)装置②~⑤中盛放的药品分别是② 、③ 、④ 、⑤ 。
(4)II的操作是 ,目的是 。
(5)该同学得出结论所依据的实验现象是 。
1.52g 铜镁合金完全溶解于50mL 密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(折算到标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
| A.该合金中铜与镁的物质的量之比是2:1 |
| B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L |
| C.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL |
向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150mL4mol/L的稀硝酸恰好使混合物完全溶解,放出2.24LNO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
| A.0.21mol | B.0.25mol | C.0.3mol | D.0.35mol |
(1)滑石一种硅酸盐矿物,其化学式为Mg3Si4O10(OH)2,用氧化物的形式表示为 。
(2)除去下列物质中所含杂质(括号内为杂质),写出除去杂质的试剂。
①Fe2O3(Al2O3) ②NO(NO2)
③Cl2 (HCl) ④FeCl3 (FeCl2)
(3)用铝箔包裹0.1mol金属钠,用针扎若干小孔,放入水中,完全反应后,用排水取气法收集到标准状况下气体的体积是_________(填字母序号)
a.1.12L b.>1.12L c.<1.12L
铜镁合金9.2g完全溶于浓硝酸中,反应中硝酸钡还原只产生10304mL(标准状况下)NO2气体。向反应后的溶液中加足量NaOH溶液,生成沉淀的质量为( )
| A.16.51g | B.23.82g | C.24.84g | D.17.02g |
将一黑色固体单质甲投入乙的浓溶液中共热,剧烈反应产生混合气体A,A存在以下转化关系:
试回答下列问题:
(1)甲是_________,B是________。(填化学式)
(2)乙的溶液通常呈黄色,写出消除黄色且不降低乙溶液的浓度的方法:________________。
(3)写出生成混合气体A的化学方程式____________________________________。
(4)写出乙的稀溶液与单质丙反应的离子方程式:_______________________________________。
1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法中不正确的是
| A.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| B.该浓硝酸中HNO3的物质的量浓度是14.0mol/L |
| C.该合金中铜与镁的物质的量之比是2:1 |
| D.得到2.54g沉淀时,加入NaOH溶液的体积是600mL |
为了避免NO、NO2、N2O4对大气的污染,常采用氢氧化钠溶液进行吸收处理(反应方程式:2NO2+2NaOH═NaNO3+NaNO2+H2O;NO2+NO+2NaOH═2NaNO2+H2O).现有由1mol NO、2mol NO2、1mol N2O4组成的混合气体恰好被1L氢氧化钠溶液吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度最小为
| A.3 mol/L | B.4 mol/L | C.5 mol/L | D.6 mol/L |
根据反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,回答下列问题:
(1)还原剂是________,还原产物是________,氧化剂是________,氧化产物是________。
(2)还原剂与还原产物的物质的量之比是________。
(3)当有8 mol HNO3参加反应时,被氧化的物质的质量为________g,反应中转移的电子的物质的量为________ mol。
NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
Ⅰ.(1)实验室用金属铜和稀硝酸制取NO的离子方程式为________________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图所示。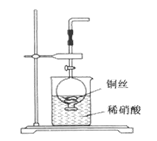
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填选项编号)。
| A.铁 | B.铝 | C.铂 | D.玻璃 |
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是________(用化学方程式表示)。
(3)以下收集NO气体的装置,合理的是________(填选项代号)。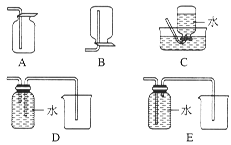
(4)假设实验中12.8 g Cu全部溶解,需要通入标况下________L O2才能使NO全部溶于水。
Ⅱ.用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列4种方法中最好的是________(填“甲”、“乙”、“丙”或“丁”)。
甲:铜 硝酸铜
硝酸铜
乙:铜 硝酸铜
硝酸铜
丙:铜 氯化铜
氯化铜 硝酸铜
硝酸铜
丁:铜 氧化铜
氧化铜 硝酸铜。
硝酸铜。
试题篮
()