将某稀硫酸和稀硝酸的混合溶液200mL。平均分成两等份。向其中一份中逐渐加入铜粉,最多能溶解19.2g;向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示(已知硝酸均只被还原为NO气体)。下列分析或结果不正确的是 
| A.第二份溶液中最终的溶质为FeSO4 |
| B.OA段产生的气体是NO,AB段的反应为 Fe+2Fe3+=3Fe2+,BC段产生的气体是H2 |
| C.原混合酸中NO-3的物质的量共为0.4mol |
| D.原混合酸中H2SO4的物质的量浓度为5mol·L-1 |
在500mL 0.2 mol·L-1的稀硝酸中加入1.92g铜片,让其充分反应。试求:
(1)产生的气体在标准状况下所占的体积为多少?
(2)反应后溶液中H+的物质的量浓度是多少?(溶液体积变化忽略不计)
下图是各种不同密度的硝酸与铁反应(相同温度)时主要还原产物的分布图。请认真读图分析,回答有关问题。
⑴下列叙述中正确的是(填序号) 。
A.图中横坐标是硝酸的密度,硝酸的密度越大,其浓度越大。
B.当还原剂和温度相同时,不同浓度的硝酸被还原的产物不是单一的,只是在某浓度时,以某种产物为主而已。
C.硝酸的浓度越大,还原产物中N元素低化合价产物越多。
D.当硝酸密度大于1.3 g·cm-3时,还原产物主要为NO、NO2
⑵ 当硝酸溶液的密度为1.36 g·cm-3时,下列化学方程式中,能较准确表达Fe与过量硝酸反应的是(填序号) 。
A.2Fe + 10HNO3 ="=" 2Fe(NO3)3 + NO↑+3NO2↑+5H2O
B.4Fe + 18HNO3 ="=" 4Fe(NO3)3 + 3NO↑+3NO2↑+9H2O
C.3Fe + 12HNO3 ="=" 2Fe(NO3)3 + Fe(NO3)2 + 2NO↑+2NO2↑+3H2O
⑶ 密度为1.26 g·cm-3,质量分数为50.0 %的硝酸,其物质的量浓度是 mol·L-1。
⑷ 限用下列仪器、药品验证由铁和过量1.36 g·cm-3硝酸反应产生的气体中含有NO(不考虑N2O4)。设计一个合理而简单的实验方案(仪器可选择使用,N2的用量可自由控制,加热装置和固定装置省略)。
第1步:反应并收集生成的气体:
①实验中气体发生装置应选择 (填装置序号),理由是 。
②装置的连接顺序是(填各装置接口的序号):[ ]→[ ] [ ]→[8] [9]→[ ]。
③检查装置气密性后,开始反应。待E中充满红棕色气体,停止实验。
第2步:验证E中有NO。
④ 取下试管E,倒立在F中,轻轻摇动试管。
确认生成的气体中有NO的现象是 。
在100mL密度为1.2g/mL稀硝酸中,加入一定量的镁和铜组成的混合物,充分反应后金属完全溶解(假设还原产物只有NO),向反应后溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀质量比原金属质量增加5.1g。则下列叙述不正确是
| A.当金属全部溶解时收集到NO气体的体积为2.24L(标准状况) |
| B.当生成沉淀的量最多时,消耗NaOH溶液体积最小为100mL |
| C.原稀硝酸的物质的量浓度一定为4 mol/L |
| D.参加反应金属总质量(m)为9.6g>m>3.6g |
在标准状况下,三个干燥的烧瓶内分别装入:干燥纯净的NH3、含有部分空气的HCl气体、体积比为4:10的NO2与O2的混合气体。分别做喷泉实验,最终三个烧瓶中所得溶液的物质的量浓度(假设溶液不外渗)之比为( )
| A.2:1:2 | B.5:5:4 | C.1:1 :1 :1 |
D.4:4:5 |
某稀硫酸和稀硝酸的混合溶液200ml,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解m g。向另一份中逐渐加入铁粉,产生的气体量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)下列分析或结果错误的是 ( )

| A.第二份溶液中最终溶质为FeSO4 |
| B.原混合酸中NO3-物质的量为0.1mol |
| C.m值为9.6 |
| D.H2SO4浓度为2.5mol/L |
向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150mL4mol/L的稀硝酸恰好使混合物完全溶解,放出2.24LNO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
| A.0.21mol | B.0.25mol | C.0.3mol | D.0.35mol |
(1)滑石一种硅酸盐矿物,其化学式为Mg3Si4O10(OH)2,用氧化物的形式表示为 。
(2)除去下列物质中所含杂质(括号内为杂质),写出除去杂质的试剂。
①Fe2O3(Al2O3) ②NO(NO2)
③Cl2 (HCl) ④FeCl3 (FeCl2)
(3)用铝箔包裹0.1mol金属钠,用针扎若干小孔,放入水中,完全反应后,用排水取气法收集到标准状况下气体的体积是_________(填字母序号)
a.1.12L b.>1.12L c.<1.12L
铜镁合金9.2g完全溶于浓硝酸中,反应中硝酸钡还原只产生10304mL(标准状况下)NO2气体。向反应后的溶液中加足量NaOH溶液,生成沉淀的质量为( )
| A.16.51g | B.23.82g | C.24.84g | D.17.02g |
将一黑色固体单质甲投入乙的浓溶液中共热,剧烈反应产生混合气体A,A存在以下转化关系:
试回答下列问题:
(1)甲是_________,B是________。(填化学式)
(2)乙的溶液通常呈黄色,写出消除黄色且不降低乙溶液的浓度的方法:________________。
(3)写出生成混合气体A的化学方程式____________________________________。
(4)写出乙的稀溶液与单质丙反应的离子方程式:_______________________________________。
1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法中不正确的是
| A.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| B.该浓硝酸中HNO3的物质的量浓度是14.0mol/L |
| C.该合金中铜与镁的物质的量之比是2:1 |
| D.得到2.54g沉淀时,加入NaOH溶液的体积是600mL |
为了避免NO、NO2、N2O4对大气的污染,常采用氢氧化钠溶液进行吸收处理(反应方程式:2NO2+2NaOH═NaNO3+NaNO2+H2O;NO2+NO+2NaOH═2NaNO2+H2O).现有由1mol NO、2mol NO2、1mol N2O4组成的混合气体恰好被1L氢氧化钠溶液吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度最小为
| A.3 mol/L | B.4 mol/L | C.5 mol/L | D.6 mol/L |
根据反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,回答下列问题:
(1)还原剂是________,还原产物是________,氧化剂是________,氧化产物是________。
(2)还原剂与还原产物的物质的量之比是________。
(3)当有8 mol HNO3参加反应时,被氧化的物质的质量为________g,反应中转移的电子的物质的量为________ mol。
NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
Ⅰ.(1)实验室用金属铜和稀硝酸制取NO的离子方程式为________________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图所示。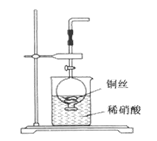
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填选项编号)。
| A.铁 | B.铝 | C.铂 | D.玻璃 |
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是________(用化学方程式表示)。
(3)以下收集NO气体的装置,合理的是________(填选项代号)。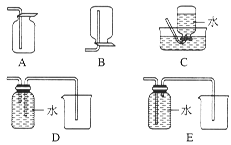
(4)假设实验中12.8 g Cu全部溶解,需要通入标况下________L O2才能使NO全部溶于水。
Ⅱ.用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列4种方法中最好的是________(填“甲”、“乙”、“丙”或“丁”)。
甲:铜 硝酸铜
硝酸铜
乙:铜 硝酸铜
硝酸铜
丙:铜 氯化铜
氯化铜 硝酸铜
硝酸铜
丁:铜 氧化铜
氧化铜 硝酸铜。
硝酸铜。
试题篮
()