将一定质量的镁、铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物全部是NO)。向反应后的溶液中加入3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加7.65g,则下列叙述中正确的是
| A.当生成沉淀达到最大量时,消耗NaOH溶液的体积为150mL |
| B.当金属全部溶解时收集到NO气体的体积为0.336L(标准状况下) |
| C.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.6mol |
| D.参加反应的金属的总质量一定是9.9g |
为了证明(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵晶体)的成分中含有NH4+、Fe2+、SO42-和H2O,下列实验叙述中不正确的是
| A.取少量硫酸亚铁铵晶体放入试管,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水 |
| B.硫酸亚铁铵晶体溶于水,得淡绿色溶液,滴入2滴KSCN溶液,溶液不显红色,再滴入几滴新制氯水,溶液变为红色,则可证明晶体的成分中含有Fe2+ |
| C.硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42- |
| D.取少量硫酸亚铁铵晶体放入试管,加入少量稀NaOH溶液,在试管口用湿润的红色石蕊试纸检验,则可证明晶体的成分中含有NH4+ |
Ⅰ.乙组同学用下列装置来证明铜与稀硝酸反应产生一氧化氮,

B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
(1)实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离。该组学生设计此步操作的目的 。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子方程式为________________________。
(3)装置E中开始时出现浅红棕色气体,用F向E中鼓入空气后,可观察到烧瓶E内气体颜色加深,产生上述现象的原因是 。
(4)一段时间后,C中白色沉淀溶解,其原因是____________________。
(5)装置D的作用是________________________。
Ⅱ.已知向含有淀粉的10mL0.2mol/LKIO3酸性溶液滴滴加0.3mol•L-1NaHSO3溶液的过程中,溶液的颜色先变蓝然后褪色,发生的离子反应如下:
①______IO3-+______HSO3-=_______I2+_______SO42-+_______H2O+ ________
②I2+HSO3-+H2O═2I-+SO42-+3H+
回答下列问题
(1)配平离子反应方程式①
______IO3-+______HSO3-=_______I2+_______SO42-+_______H2O+ ________
(2)根据①②反应写出还原性粒子HSO3-、I2、I-由强到弱的顺序_________________;
(3)当溶液刚好褪色时,则消耗的NaHSO3溶液的体积为___________________;
(4)预测已知向含有淀粉的NaHSO3溶液滴加KIO3溶液的现象____________________
某课外活动小组设计了以下实验验证Ag与浓硝酸反应的过程中可能产生NO,其实验流程图如下:
(1)测定硝酸的物质的量反应结束后,从如图装置B中所得100 mL溶液中取出25.00 mL溶液,用0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示。在B容器中生成硝酸的物质的量为__________________________mol,则Ag与浓硝酸反应过程中生成的NO2在标准状况下的体积为_________________________mL。
(2)测定NO的体积
①从如图所示的装置中,你认为应选用________装置进行Ag与浓硝酸反应实验,选用的理由是_______。
②选用如图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是______________(填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置___________(填“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(3)气体成分分析
若实验测得NO的体积为112.0 mL(已折算到标准状况),则Ag与浓硝酸反应的过程中____________(填“有”或“没有”)NO产生,作此判断的依据是_____________。
氮化铝(AlN0是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下三种实验方案。(已知:AlN+NaOH+H2O=NaAlO2+ NH3↑)
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。

(1)上图C装置中球形干燥管的作用是 。
(2)完成以下实验步骤:组装好实验装置,首先 ,再加入实验药品,接下来的实验操作是 ,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是 。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见 。
【方案2】用下图装置测定m g样品中A1N的纯度(部分夹持装置已略去)。

(4)为测定生成气体的体积,量气装置中的X液体可以是 (填选项序号)。
a.CCl4 b.C6H6 c.NH4Cl溶液 d.H2O
(5)若m g样品完全反应,测得生成气体的体积为VmL(已转换为标准状况),则A1N的质量分数是 (用含m、V的数学表达式表示)。
【方案3】按以下步骤测定样品中A1N的纯度:

(6)步骤②生成沉淀的离子方程式为 。
(7)若在步骤③中未洗涤,测定结果将 (填“偏高”、“偏低”或“无影响”)。
某课外活动小组设计了以下实验验证Ag与浓硝酸反应的过程中可能产生NO。其实验流程图如下:
(1)测定硝酸的物质的量反应结束后,从如图装置B中所得100 mL溶液中取出25.00 mL溶液,用0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示。在B容器中生成硝酸的物质的量为______ mol,则Ag与浓硝酸反应过程中生成的NO2在标准状况下的体积为___________mL。
(2)测定NO的体积
①从如图所示的装置中,你认为应选用________装置进行Ag与浓硝酸反应实验,选用的理由是_______。
②选用如图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是__________(填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置_______(填“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(3)气体成分分析
若实验测得NO的体积为112.0 mL(已折算到标准状况),则Ag与浓硝酸反应的过程中______(填“有”或“没有”)NO产生,作此判断的依据是_________。
(13分)半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)
已知:
①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。
②PCl3遇水会强烈水解生成H3PO3和HCl;
③PCl3遇O2会生成POCl3,POCl3溶于PCl3。
④PCl3、POCl3的熔沸点如表:
| 物质 |
熔点/℃ |
沸点/℃ |
| PCl3 |
-112 |
75.5 |
| POCl3 |
2 |
105.3 |
请回答下列问题:
(1)A装置中制氯气的离子方程式为____________。
(2)B中所装试剂是_______;F中碱石灰的作用有两种,分别是______、_______。
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用是_______。
(4)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后,通过_____(填实验操作名称),即可得到较纯净的PCl3。
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为_______。
(6)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol/L的Na2S2O3,溶液滴定;
④重复②、③操作,平均消耗Na2S2O3溶液8.40mL。
已知:H3PO3+I2=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,假设测定过程中没有其他反应,该产品中PCl3的质量分数为_________。
某研究性实验小组欲验证浓硝酸在与Cu、Ag合金的反应过程中除生成NO2气体外,还会有少量NO生成、并测定Cu、Ag合金中Cu的质量分数.查阅相关资料表明:“常温下,NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在.”为此,他们设计了如图所示的装置.

请回答下列问题
(1)写出A中Cu与HNO3反应可能的化学方式 .
(2)实验开始前先打开A部分的活塞K1,持续通入一段时间的氮气再关闭K1,其目的是 ;装置中B瓶的作用是 .
(3)停止反应后,打开D中的活塞K2并通入O2,若有NO生成,则D中出现的现象是 ;实验发现,通入的O2温度高低对实验现象有较大影响,为便于观察应通入(填“热”或“冷”) 的O2.
(4)为减小实验误差,在A中反应完成和D中出现现象后,还应继续进行的操作是 .
(5)实验测得如下数据:实验前,Cu、Ag合金的质量:15.0g,浓HNO3:40mL 13.5mol•L﹣1;实验后A溶液:V=40mL c(H+)=1.0mol•L﹣1.假设反应中HNO3既无挥发也无分解,则:
①参加反应的HNO3的物质的量为 mol.
②若已测出反应后E装置的生成物中含氮元素的质量,则为确定合金中Cu的质量分数还需测定的数据是 .
(12分)(NH4)2SO4是常见的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。
【查阅资料】(NH4)2SO4在260℃和400℃时分解产物不同。
【实验探究】该小组拟选用下图所示装置进行实验(夹持和加热装置略)
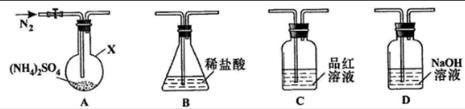
实验1:连接装置A-B-C-D,检查气密性,按图示加入试剂(装置B盛0.5000mol/L盐酸70.00mL)。通入N2排尽空气后,于260℃加热装置A一段时间,停止加热,冷却,停止通入N2。品红溶液不褪色,取下装置B,加入指示剂,用0.2000mol/L NaOH溶液滴定剩余盐酸,终点时消耗NaOH溶液25.00 mL。经检验滴定后的溶液中无SO42-。
(1)仪器X的名称是________。
(2)滴定前,下列操作的正确顺序是_________(填字母编号)。
a.盛装0.2000mol/L NaOH溶液
b.用0.2000mol/L NaOH溶液润洗
c.读数、记录
d.查漏、清洗
e.排尽滴定管尖嘴的气泡并调整液面
(3)装置B内溶液吸收气体的物质的量是________mol。
实验2:连接装置A-D-B,检查气密性,按图示重新加入试剂。通入N2排尽空气后,于400℃加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2。观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO32-,无SO42-。进一步研究发现,气体产物中无氮氧化物。
(4)检验装置D内溶液中有SO32-,无SO42-的实验操作和现象是__________。
(5)装置B内溶液吸收的气体是____________。
(6)(NH4)2SO4在400℃分解的化学方程式是_____________。
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,最低可以还原到-3价。某同学取一定量的铁铝合金与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4 mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:

(1)请写出该合金中铁与硝酸反应的离子方程式 。
(2)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为 。
(3)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为 。
(4)B与A的差值为 mol。
(5)B点对应的沉淀的物质的量为 mol,C点对应的氢氧化钠溶液的体积为_____ mL。
为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习:
【查阅资料】金属活泼性不同,其硝酸盐分解产物不同
(1)K→Na活泼金属的硝酸盐分解生成亚硝酸盐和氧气;
(2)Mg→Cu等较活泼金属的硝酸盐分解生成氧化物、NO2和O2;
(3)Hg以后不活泼金属的硝酸盐分解生成金属、NO2和O2。
2KNO3 2KNO2↑+O2↑ 2Cu(NO3)2
2KNO2↑+O2↑ 2Cu(NO3)2 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑
2AgNO3 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑
I:【实验一】探究Fe(NO3)2热分解固体产物中Fe元素的价态。该小组甲同学将其溶于足量的稀H2SO4得到相应两份溶液,进行以下探究实验。①向一份溶液中滴入少量KSCN溶液;②少量稀酸性KMnO4溶液中滴入另一份溶液。现象:①溶液变红色;②溶液变红色。
(1)则Fe(NO3)2分解的化学方程式是 。
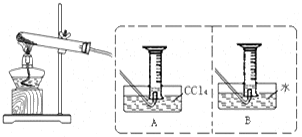
II:【实验二】探究Fe(NO3)2热分解气体产物的性质。小组乙、丙同学进行了如下图所示的实验(收集时操作恰当,几乎没有空气)
实验步骤:①连接仪器;②检查装置气密性;③取一定质量Fe(NO3)2装于大试管,并重新连接好仪器;④加热;⑤……
(2)乙同学使用A装置收集气体,恰好收集到54mL红棕色气体,要从水槽中取出量筒,乙同学的正确操作方法是 。
(3)丙同学取等质量Fe(NO3)2的在同样条件下热分解,用B装置收集气体产物,可收集到气体_____mL。
III:【实验三】探究固体混合物的组成和特征
(4)小组丁同学取KNO3、 Cu(NO3)2、 Fe(NO3)2混合粉末充分加热后用排水法未收集到任何气体,则KNO3、Cu(NO3)2、 Fe(NO3)2物质的量之比可能为____________。
| A.1∶2∶2 | B.2∶1∶3 | C.1∶2∶3 | D.3∶8∶5 |
(5)取0.6mol由KNO3、 Cu(NO3)2、 Fe(NO3)3按等物质的量之比混合而成的粉末溶于100mL 3mol/L的稀硫酸中,再向溶液中加入足量的铜粉,则最多可溶解铜粉质量为_________
氨气是一种重要的化工产品,工业上可以按照下图所示流程生产氨气:

(1)原料气之一氮气的工业制取方法是 ,写出氨气的工业用途(任答一点) 。
(2)写出合成塔中发生的反应的化学反应方程式 。在冷却塔中对混合气体进行冷却,冷水的入口 (答m或n)。
(3)设备C的作用 。其分离器中的过程对整个工业合成氨的意义 (试结合平衡移动原理回答)。
(4)在原料气制备过程中混有 CO对催化剂有毒害作用,欲除去原料气中的 CO,可通过如下反应来实现:CO(g)+H2O(g) CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过80%,则起始物中c(H2O):c(CO)不低于 (精确到小数点后一位)。
CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过80%,则起始物中c(H2O):c(CO)不低于 (精确到小数点后一位)。
磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在电炉中高温(~1550℃)下通过下面三个反应共熔得到。
①4Ca3(PO4)2(s)+10C(s)=12CaO(s)+2P4(s)+10CO2(g)ΔH1=+Q1kJ·mol-1
②CaO(s)+SiO2(s)=CaSiO3(s) ΔH2=-Q2 kJ·mol-1
③CO2 (g)+C(s)=2CO(g) ΔH3=+Q3kJ·mol-1
已知:CaSiO3的熔点(1546℃)比SiO2低。
写出由磷酸钙矿制取白磷总的反应方程式____________。
(2)白磷在热的浓氢氧化钾溶液中歧化得到一种次磷酸盐(KH2PO2)和一种气体 (写化学式)。
(3)磷的重要化合物NaH2PO4可通过H3PO4与NaOH溶液反应获得。工业上为了使反应的主要产物是NaH2PO4,通常将pH控制在 之间(已知磷酸的各级电离常数为:K1 = 7.1×10−3 K2 = 6.3×10−8 K3 =4.2×10−13 lg7.1≈0.9 lg6.3≈0.8 lg4.2≈0.6) 。Na2HPO4溶液显碱性,若向其溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是 (用离子方程式表示)。
(4)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P 4+60CuSO4+96H2O= 20Cu3P+24H3PO4+60H2SO4
60molCuSO4能氧化白磷的物质的量是 。
NH3及其盐都是重要的化工原料。
(1)用NH4Cl和Ca(OH)2制备NH3的化学方程式为 ;该反应发生、气体收集和尾气处理装置依次为 。

(2)按下图装置进行NH3性质实验。
先打开旋塞1,B瓶中的现象是 ,稳定后,关闭旋塞1。再打开旋塞2,B瓶中的现象是 。

(3)写出NH4Cl溶液水解的离子方程式 。
设计实验,探究某一种因素对溶液中NH4Cl水解程度的影响。
限选试剂与仪器:固体NH4Cl、蒸馏水、250mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、pH计、温度计、恒温水浴槽(可调控温度)
①实验目的:探究 对溶液中NH4Cl水解程度的影响。
②设计实验方案,拟定实验表格,完整体现实验方案(列出能直接读取数据的相关物理量及需拟定的数据,数据用字母表示;表中“V(溶液)”表示所配制溶液的体积)。
| 物理量 实验序号 |
V(溶液)/mL |
NH4Cl质量/g |
温度/℃ |
|
…… |
| 1 |
250 |
|
|
X |
…… |
| 2 |
250 |
|
|
|
…… |
③按实验序号1所拟数据进行实验,若读取的待测物理量的数值为X,则NH4Cl水解反应的平衡转化率为 (只列出算式,忽略水自身电离的影响)。
(16分)氮化铝(AlN)陶瓷是一种类金刚石氮化物的新型无机非金属材料,最高可稳定到2200°C,导热性好,热膨胀系数小,是良好的耐热冲击材料。抗熔融金属侵蚀的能力强,是熔铸纯铁、铝或铝合金理想的坩埚材料。工业用氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。现要通过实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理
①已知Al4C3与硫酸反应可生成CH4,则该反应的离子方程式是______________。
②AlN溶于强酸生成铵盐,溶于氢氧化钠溶液生成氨气,请写出AlN与NaOH溶液反应的化学方程式___________。
(2)实验装置(如下图所示)

(3)实验过程
①连接实验装置,检验装置的气密性。称得D装置的质量为yg,滴定管的读数为amL。
②称取xgAlN样品置于锥形瓶中;塞好胶塞,关闭活塞K2、K3,打开活塞K1,通过分液漏斗加入过量____(填化学式),与锥形瓶内物质充分反应。
③待反应进行完全后,关闭活塞K1,打开活塞K3,通过分液漏斗加入过量 _______(填化学式),与锥形瓶内物质充分反应。
④打开K2,通过打气装置通入空气一段时间。
⑤记录滴定管的读数为bmL,称得D装置的质量为zg。
(4)数据处理与问答
①在上述装置中,设置活塞K2的目的是__________。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积_________(填“偏大”,“偏小”或“无影响”)。
③Al4C3的质量分数为 ____,AlN的质量分数为_______。
试题篮
()