科学的假设和猜想是科学探究的先导和价值所在。在下列假设或猜想引导下的探究肯定没有意义的是
| A.探究SO2和Na2O2反应可能有Na2SO4生成 |
| B.探究NO2可能被NaOH溶液完全吸收生成NaNO2、NaNO3和H2O |
| C.探究向滴有酚酞试液的NaOH溶液中通入Cl2,酚酞红色褪去的原因是溶液的酸碱性改变还是HClO的漂白作用 |
| D.探究NO和N2O可能化合生成NO2 |
实验室中保存下列试剂的方法,不正确的是
| A.保存氢氧化钠溶液,常用带橡胶塞的玻璃瓶 |
| B.保存浓硝酸,常用带玻璃塞的棕色试剂瓶 |
| C.保存金属铝时,常在试剂瓶中加入煤油进行封存 |
| D.保存氢氟酸时,常用塑料瓶而不用玻璃瓶 |
高氯酸铵(NH4ClO4)和铝粉常用作火箭推进剂的固体燃料。高温时,NH4ClO4的分解反应是:2NH4ClO4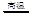 N2↑+4H2O↑+Cl2↑+2O2↑,下列有关NH4ClO4的分解及保存方法说法不合理的是
N2↑+4H2O↑+Cl2↑+2O2↑,下列有关NH4ClO4的分解及保存方法说法不合理的是
| A.点燃铝粉可以引发NH4ClO4分解 |
| B.NH4ClO4迅速分解时可能会引发爆炸 |
| C.NH4ClO4应低温通风保存,远离火种、热源 |
| D.0.5 mol NH4ClO4分解时产生的气体体积是44.8 L |
根据下列有关实验得出的结论一定正确的是
| 选项 |
方法 |
结论 |
| A |
实验室制氢气,向稀H2SO4中滴加少量Cu(NO3)2溶液 |
可以加快制备氢气的反应速率 |
| B |
向Fe(NO3)2溶液中滴入用硫酸酸化的H2O2溶液, 则溶液变黄 |
氧化性:H2O2>Fe3+ |
| C |
相同温度下,等质量的大理石与等体积、等浓度的盐酸反应 |
反应速率: 粉状大理石>块状大理石 |
| D |
吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行 |
则该反应的△S<0 |
下图是用点滴板探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水后,立即用培养皿罩住整个点滴板。下列对实验现象的解释正确的是

| 选项 |
实验现象 |
解释 |
| A |
红色石蕊试纸变蓝 |
NH3极易溶于水 |
| B |
浓硫酸附近无白烟 |
NH3与浓硫酸不发生反应 |
| C |
氯化铝溶液变浑浊 |
NH3与AlCl3溶液反应:Al3++3OH–→Al(OH)3↓ |
| D |
浓盐酸附近有白烟 |
NH3与挥发出的HCl反应:NH3+HCl→NH4Cl |
空气污染已成为人类社会面临的重大威胁。下列气体不属于大气污染物的是
| A.NO | B.CO2 | C.SO2 | D.NO2 |
下列有关实验操作、现象、解释和结论都正确的是( )
| |
操 作 |
现 象 |
解释、结论 |
| A |
把过量的Fe粉中加入硝酸中充分反应,滴入KSCN溶液 |
溶液呈红色 |
稀硝酸将Fe氧化为Fe3+ |
| B |
向饱和Na2CO3溶液中通入足量CO2 |
溶液变浑浊 |
析出了Na2CO3晶体 |
| C |
Al箔插入稀硝酸中 |
无现象 |
Al在硝酸中钝化,形成致密的氧化膜 |
| D |
用玻璃棒蘸取浓氨水点到红色石蕊试纸上 |
试纸变蓝色 |
浓氨水呈碱性 |
关于下列各装置图的叙述中,不正确的是
| A.装置①中,d为阳极,c为阴极 |
| B.装置②可用于收集H2、NH3、CO2、Cl2、HC1、NO2等气体 |
| C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸 |
| D.装置④可用于干燥、收集氨气,并吸收多余的氨气 |
NH3可消除NO的污染,反应方程式为:6NO+4NH3=5N2+6H2O。现有NO与NH3的混合物共1 mol充分反应,若还原产物比氧化产物多1.4g,则下列判断中正确的是( )
| A.原混合物中NO与NH3的物质的量之比可能为3:2 |
| B.有0.6 mol NH3被氧化 |
| C.生成还原产物2.8g |
| D.原混合气体中含氨气为0.2 mol或0.7 mol |
下列有关氮元素及其化合物的表示正确的是
A.质子数为7、中子数为8的氮原子: |
B.溴化铵的电子式: |
C.氮原子的结构示意图: |
D.间硝基甲苯的结构简式: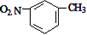 |
在防止禽流感疫情时,防疫部门使用了大量含氯类消毒剂,其中的一氯胺(NH2Cl)是一种长效缓释有机氯消毒剂,能水解生成具有强氧化性的物质,其杀菌能力是一般含氯消毒剂的4~5倍。下列有关一氯胺的说法正确的是( )
| A.一氯胺中氯元素的化合价为-1价 |
| B.一氯胺水解的产物为NH2OH(羟氨)和HCl |
| C.一氯胺起消毒作用的物质与漂白粉起消毒作用的物质相同 |
| D.一氯胺的摩尔质量为51.5 |
试题篮
()