通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是
| |
现象 |
解释 |
| A |
KI淀粉溶液中通入Cl2,溶液变蓝 |
Cl2能与淀粉发生显色反应 |
| B |
SO2能使酸性高锰酸钾溶液褪色 |
SO2具有还原性 |
| C |
某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 |
该溶液中一定含有SO42- |
| D |
铁与稀硝酸反应有气泡产生 |
铁与稀硝酸发生了置换反应 |
一定是的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合物,且体积比为1﹕1,则V可能为( )
| A.13.5L | B.9.0L | C.16.8L | D.15.7L |
用右图所示装置进行下列实验,实验结果与预测的现象不一致的是

| |
①中的物质 |
②中的物质 |
预测①的现象 |
| A |
酚酞溶液 |
浓盐酸 |
无明显现象 |
| B |
淀粉KI溶液 |
浓硝酸 |
无明显现象 |
| C |
AlCl3溶液 |
浓氨水 |
有白色沉淀 |
| D |
湿润红纸条 |
饱和氯水 |
红纸条褪色 |
1.92 g Cu投入到一定量的浓硝酸中,铜完全溶解,生成的气体的颜色越来越浅,共收集到 672 mL 的气体(标准状况下).将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水,则通入的氧气的体积为( )
| A.0.336L | B.0.224L | C.0.168L | D.0.504L |
利用下图M、N两个装置进行相关实验,下列有关说法正确的是

| 选项 |
所用装置 |
描述 |
结论 |
| A |
M |
W:BaCl2 ;X:CO2 Y:SO2 |
M中有白色沉淀生成 |
| B |
M |
W:饱和食盐水;先通入X:CO2,再通入Y:NH3 |
M中制得小苏打 |
| C |
N |
X:NH3 Y:Cl2 |
Z出口有白烟产生 |
| D |
N |
X:NH3 Y:O2 |
Z出口有红棕色气体 |
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入5mol/L NaOH溶液,所加的NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列说法不正确的是( )

| A.稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵 |
| B.图中C点对应溶液体积为48mL |
| C.原硝酸溶液中含硝酸的物质的量为0.5mol |
| D.样品中铝粉和铁粉的物质的量之比5:3 |
在15.2g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成气体X,再向所得溶液中加入足量的NaOH溶液,生成25.4g沉淀,则下列表示气体X组成的选项中合理的是 ( )
| A.0.3mol NO、0.1mol NO2 | B.0.3mol NO2 |
| C.0.6mol NO | D.0.3mol NO2、0.1mol NO |
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
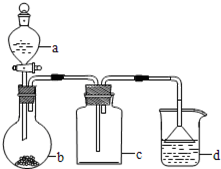
| 选项 |
a中的物质 |
b中的物质 |
c中的物质 |
d中的物质 |
| A |
浓氨水 |
CaO |
NH3 |
H2O |
| B |
浓硫酸 |
Na2SO3 |
SO2 |
NaOH溶液 |
| C |
稀硝酸 |
Cu |
NO2 |
H2O |
| D |
浓盐酸 |
MnO2 |
Cl2 |
NaOH溶液 |
在t℃时,将agNH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρg·cm—1,质量分数
为ω,其中含NH4+的物质的量为b moL。下列叙述中正确的是( )
A.溶质的质量分数为ω= |
B.溶质的物质的量浓度 |
C.溶液中c(OH—)= |
| D.上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω |
向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150mL4mol/L的稀硝酸恰好使混合物完全溶解,放出2.24LNO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
| A.0.21mol | B.0.25mol | C.0.3mol | D.0.35mol |
某无色混合气体中可能含有Cl2、O2、HCl、SO2、NO2、NO、NH3中的两种或多种。将此无色混合气体通过品红溶液后,品红溶液褪色;把剩余气体排入空气中,气体很快变为红棕色,该无色混合气体遇浓盐酸未看到明显现象。下列关于原混合气体成分的判断正确的是
| A.一定有SO2、NH3和NO | B.一定有NO和HCl |
| C.可能有Cl2和O2 | D.一定没有Cl2、NO2、NH3和O2 |
将过量铁粉放入100mL3mol/L的HNO3溶液中,假设还原产物只有NO且HNO3完全反应,则参加反应的Fe的质量为
| A.2.8g | B.6.3g | C.5.6g | D.11.2g |
2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家格哈德·埃特尔。他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论。在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示。下列说法正确的是 
| A.NO2是该过程的最终产物 |
| B.NO和O2必须在催化剂表面才能反应 |
| C.汽车尾气的主要污染成分是CO2和NO |
D.该催化转化的总反应方程式为:2NO +O2 +4CO 4CO2+N2 4CO2+N2 |
试题篮
()