A~H等8种物质存在如下转化关系(反应条件、部分产物未标出)。已知A是正盐,B是能使品红溶液褪色的气体,G是红棕色气体。按要求回答问题:
(1)写出下列物质的化学式:A ,B 。
(2)写出下列反应的化学方程式:E→F ;
写出下列反应的离子方程式:A→E ;
H的浓溶液与木炭反应的化学方程式: 。
(3)检验某溶液中是否含D中阴离子的方法是 。
工业盐中含有NaNO2,外观和食盐相似,有咸味,人若误食会引起中毒,致死量为0.3g—0.5g。已知NaNO2能发生如下反应:aNO +xI-+yH+=bNO↑+cI2+zH2O,
+xI-+yH+=bNO↑+cI2+zH2O,
请回答下列问题:
(1)上述反应中,x、y、z的数值分别是 (全对才给分)。
(2)根据上述反应,可用化学试纸和生活中常见物质进行实验来鉴别工业盐
和食盐,现有碘化钾淀粉试纸,则还需选用的生活中常见物质的名称为
。
(3)某工厂废切削液中含有2%—5%的NaNO2,直接排放会造成水污染,但加
入下列物质中的某一种就能使NaNO2转化为不引起污的N2,该物质是 ,
a.NaCl b.H2O2 c.NH4Cl d.浓H2SO4
所发生反应的离子方程式为: 。
NOx是汽车尾气中的主要污染物之一。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式: 。
(2)汽车发动机工作时会引发N2和O2反应,已知键能如下:N2(g)945 kJ/mol ;O2(g)498 kJ/mol ;NO(g)630 kJ/mol
写出该反应的热化学方程式: 。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOX的排放。
①当尾气中空气不足时,NOX在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式: 。
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOX生成盐。其吸收能力顺序如下:12MgO <2oCaO <38SrO<56BaO。原因是 (已知:元素的金属性逐渐增强,金属氧化物对NOX的吸收能力逐渐增强)。
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
①Pt电极上发生的是 反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式: 。
研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为 。利用反应6NO2+ 8NH3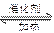 7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH="-196.6" kJ·mol-1
2SO3(g) ΔH="-196.6" kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH="-113.0" kJ·mol-1
2NO2(g) ΔH="-113.0" kJ·mol-1
① 写出NO2氧化SO2的热化学方程式
②一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
③测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= 。
(3)CO可用于合成甲醇,反应方程式为
CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。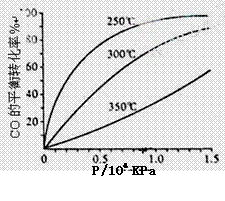
该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择
此压强的理由是 。
(13分)X、Y、Z、W、G、和H均由短周期元素组成,它们是中学化学中常见的气体,具有如下性质:
①X、Y、G能使湿润的蓝色石蕊试纸变红,H能使湿润的红色石蕊试纸变蓝,Z、W不能使湿润的石蕊试纸变色;
②X和H相遇产生白烟;
③Y是形成酸雨的主要气体且能使品红溶液褪色;
④Z和W相遇生成红棕色气体;
⑤G在W中燃烧可以产生Y和H2O;⑥回答下列问题:
(1) H的化学式是__________,实验室制取H的化学反应方程式是___________________________;
(2)Z的化学式是________,W的化学式是__________________;
(3)⑤中发生反应的化学方程式是___________________________________________;
(4)实验室制备、收集干燥的Y气体,所需仪器如下。装置A产生Y气体,按气流方向连接各仪器接口,顺序为a



 f:装置D的作用是 ,装置E中NaOH溶液的作用是 。
f:装置D的作用是 ,装置E中NaOH溶液的作用是 。
工业盐中含有NaNO2,外观和食盐相似,有咸味,人若误食会引起中毒,致死量为0.3g~0.5g。已知NaNO2能发生如下反应:2NO + xI-+ yH+ = 2NO↑+ I2 + zH2O,请回答下列问题:
+ xI-+ yH+ = 2NO↑+ I2 + zH2O,请回答下列问题:
(1)上述反应中,x的数值是 ,y的数值是 。
(2)根据上述反应,可用化学试纸和生活中常见物质进行实验来鉴别工业盐和食盐,现
有碘化钾淀粉试纸,则还需选用的生活中常见物质的名称为 。
(3)某工厂废切削液中 含有2%—5%的NaNO2,直接排放会造成水污染,但加入下列
含有2%—5%的NaNO2,直接排放会造成水污染,但加入下列
物质中的某一种就能使NaNO2转化为不引起污染的N2,该物质是 ,
a.NaCl b.H2O2 c.NH4Cl d.浓H2SO4
所发生反应的离子方程式为: 。
根据题意填写下列空格:
(1)c mol·L-1 KCl溶液的密度为ρg/cm3,则此KCl溶液的质量分数为 ;
(2)标准状况下,将充满NO2的试管倒立于盛有蒸馏水的水槽中,足够长时间后,假设不考虑溶质扩散,试管中溶质的物质的量浓度为 mol·L-1。
1.92gCu片与一定量的浓HNO3作用,当收集到NO2和NO气体共1.12L时(标准状况),金属铜恰好全部作用。则:
(1)反应中消耗HNO3 mol,转移电子 mol
(2)用排水法收集生成的气体,最后气体的体积为 L (标准状况)
(3)向收集到的气体中通入 mL O2(标准状况)才能使水刚好充满整个集气容器。
NO、NO2、NH3、SO2、CO等都是空气污染物。
(1)酸雨的形成主要是大气中的_________溶于水后形成了酸性溶液。
(2)在汽车的排气管上装一个催化转化装置,可使汽车尾气中的NO与CO反应,生成氮气和碳的另一种无污染的气体,请完成该转化的化学方程式: NO + CO—N2+ 。
除去下表内各物质中含有的少量杂质,写出除杂试剂,并填写分离方法。
| 序号 |
物质 |
杂质 |
所加试剂 |
分离方法 |
| (1) |
NO |
NO2 |
|
|
| (2) |
Fe粉 |
Al粉 |
|
|
| (3) |
氯化钠固体 |
氯化铵固体 |
|
|
汽车已经成为重要的交通工具,但其排放的尾气是空气的主要污染物之一。已知汽车尾气中的主要污染物:CmHn(烃)、SO2、NOx、CO和C等,请回答下列有关问题:
(1)若用CmHn表示汽油的主要组成,CmHn在空气中完全燃烧的化学方程式为________________,汽油燃烧产生能量为汽车提供了动力,这一过程中能量的转化是由________能转化为________能,最终转化为机械能;
(2)通过车用燃油的精炼加工处理,可减少汽车尾气中的__________(填化学式,多填本空不得分)排放;
(3)目前汽车尾气多采用催化转化的方法加以治理,写出在催化剂作用下NOX与CO反应的化学方程式________。
次磷酸H3PO2是一种强还原剂,将它加入CuSO4水溶液,加热到40~50℃,析出一种红棕色的难溶物A。经鉴定:反应后的溶液是磷酸和硫酸的混合物;X射线衍射证实A中各元素的原子个数相等;A的主要化学性质如下:
①温度超过60℃,分解成金属铜和一种气体;
②在氯气中着火;
③与盐酸反应放出气体。
(1)A的化学式为
(2)A的生成反应方程式为
(1)在中学所学的金属单质中,在冷的浓硫酸或硝酸中会发生钝化现象的有_______(填化学式);
(2)写出铁与浓硫酸(足量)在加热条件下反应的化学方程式___________________;
(3)铝分别与氢氧化钠溶液和稀硫酸反应,若在相同情况下得到相同体积的气体,则两个反应中消耗氢氧化钠与硫酸的物质的量之比为___________。
(13分)已知A、B、C、D、E、F是含有同一种元素的化合物,其中F是能使湿润红色石蕊试纸变蓝的气体,它们之间能发生如下反应:①A+H2O→B+C ②C+F→D ③D+NaOH F+E+H2O
F+E+H2O
(1)写出它们的化学式:A________、B________、C________、D________、E________、F________;
(2)写出各步反应的化学方程式,并指出反应①的氧化剂和还原剂。
①________________________,氧化剂________、还原剂________。
②________________________。
③________________________。
(3)工业生产C的过程中有如下一步反应,即F经催化氧化生成B和H2O,写出该步反应的化学方程式________________________。
【化学—选修2:化学与技术】(15分)
I、污水经过一级、二级处理后,还含有少量Cu2+、Hg2+、Pb2+等重金属离子,可加入沉淀剂使其沉淀。下列物质不能作为沉淀剂的是
| A.氨水 | B.硫化氢气体 | C.硫酸钠溶液 | D.纯碱溶液 |
II、合成氨的流程示意图如下:
回答下列问题:
(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是 , ;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式 ,
;
(2) 设备A中含有电加热器、触煤和热交换器,设备A的名称 ,其中发生的化学反应方程式为 ;
(3) 设备B的名称 ,其中m和n是两个通水口,入水口是 (填“m”或“n”)。不宜从相反方向通水的原因 ;
(4) 设备C的作用 ;
(5)在原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g) CO2 (g)+ H2 (g) , 已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于 。
CO2 (g)+ H2 (g) , 已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于 。
试题篮
()