(9分)氮及其化合物在很多方面有重要的用途。
(1)氮的氧化物有多种。现有NO和NO2的混合气体,其中N 、O元素质量之比为7:12,则该混合气中NO和NO2的物质的量之比为 。
(2)氨气的实验室制法有多种,若不加热,制取氨气所用试剂可以用浓氨水和生石灰,产生氨气的原因是: ;氨气的检验方法是: 。
(3)硝酸具有很强的氧化性,王水是浓硝酸与浓盐酸的混合液,可以溶解金、铂等金属。铂溶于王水时产生[PtCl6] 2-和一种无色气体,该气体遇空气变为红棕色,写出该反应的离子方程式 。
(4)氮的一种氢化物肼(即N2H4)用作发射卫星的燃料。
已知: N2 + 2O2 = 2NO2 N2H4 + O2 = N2 + 2H2O
发射卫星用气体肼为原料,以NO2为氧化剂,两种物质反应生成氮气和水蒸气,反应中每有4mol电子转移,则生成N2质量为 g。
饮用水中含有一定浓度的NO3一将对人类健康产生危害,NO3一能氧化人体血红蛋白中的Fe(II),使其失去携氧功能。为了降低饮用水中NO3一的浓度,某兴趣小组提出如下方案:
请回答下列问题:
(1)已知过滤后得到的滤渣是一种混合物,则在溶液中铝粉和NO3一反应的离子方程式为 。
(2)该方案中选用熟石灰调节pH,理由是 、 ,在调节pH时,若pH过大或过小都会造成 的利用率降低。
(3)用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为 _。
(4)饮用水中的NO3-主要来自于NH4+。已知在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:

试写出1 mol NH4+ (aq)全部氧化成NO3-(aq)的热化学方程式是 。
工业制硝酸经以下一系列反应:
请回答:
(1)写出反应④的化学方程式 ,实验室收集NO的方法是 。
(2)对于氮的化合物,下列说法不正确的是(选填序号字母) 。
a.氨可用作制冷剂
b.铵态氮肥一般不能与碱性化肥共同使用
c.硝酸可用于制化肥、农药、炸药、染料、盐类等
d.某浓硝酸中含有溶质2mol,标准状况下,该浓硝酸与足量的铜完全反应能生成1mol NO2
(3)已知:H2(g)+1/2 O2(g)=H2O(g) △H1=-241.8kJ/mol
N2(g)+ 3H2(g)=2NH3(g) △H2=-92.0kJ/mol
则34g氨气与氧气反应生成N2(g)与H2O(g)时,△H= kJ/mol。
(4)氨气在微生物的作用下与氧气反应生成HNO2,写出该反应的化学方程式 。
(5)氨气是氮肥工业的重要原料,某化肥厂生产铵态氮肥(NH4)2SO4的部分工艺流程如下:
向装有CaSO4悬浊液的沉淀池中先通氨气,再通CO2的原因(请从溶解度和溶解平衡角度分析) 。
(本题共17分)铁元素、氮元素有多种可变价态,在氧化还原反应中常以不同价态出现,根据题中信息,完成下列填空:
28.金属与硝酸反应通常还会生成NO和NO2,当n(NO): n(NO2)<1时,产生的气体可以完全被氢氧化钠溶液吸收,写出除去这两种气体的方法,以化学方程式表示 、
29.室温下,0.1mol/L的亚硝酸、次氯酸钠的电离常数HNO2:Ki ="7.1×" 10-4, HClO: Ki ="2.98×" 10-8,将0.1mol/L的亚硝酸稀释100倍,c(H+)=将(填“不变”、“增大”、“减小”) ;Ki值将(填“不变”、“增大”、“减小”) 。写出HNO2、HClO、NaNO2、NaClO四种物质,可能相互之间发生的离子互换反应的离子方程式 。
30. 亚硝酸钠与氯酸钠都是白色粉末,且都有咸味,但亚硝酸盐都有毒性,通常它们可以通过加入热的白醋鉴别,亚硝酸钠遇到白醋会产生红棕色刺激性气味气体,该气体为 ;实验室鉴别氯化钠和亚硝酸钠的方法之一是测定等浓度NaNO2、NaClO的pH,其鉴别的理由是 。
31.现有11.2g铁单质恰好与稀硝酸反应,生成无污染的单质气体,该单质气体为 ,在反应后的溶液中加入铜粉,铜粉可以继续溶解,且无气体生成,铁与稀硝酸的反应产物中一定含有的金属阳离子是 ,若反应后的溶液最多可溶解铜粉6.4g,写出上述过程中铁与稀硝酸反应的化学方程式 。
(本题共12分)
氨气是重要的化工原料。
38.实验室可用浓氨水和_____(选填编号)来制取氨气。
a.烧碱 b.生石灰 c.氯化铵
检验氨气易溶于水的简单操作是:收集一试管氨气, 。
39.往饱和食盐水中依次通入足量的NH3和足量的CO2,生成沉淀的化学式为 ;过滤后,使余液尽可能析出较多NH4Cl晶体的方法是:再通入足量的NH3、冷却并加入 。
侯德榜制碱法(联合氨碱法)的CO2来自_____(选填编号)。
a.石灰石煅烧
b.含碳物质燃烧
c.合成氨厂的副产品
40.往CuSO4溶液中滴加氨水,先有沉淀析出,后沉淀溶解溶液呈深(绛)蓝色,有[Cu(NH3)4]2+生成。往溶液中滴加稀硫酸,溶液变为淡蓝色。颜色变浅的主要原因可能是:
①溶液变稀;②[Cu(NH3)4]2++4H+ Cu2+ + 4NH4+
Cu2+ + 4NH4+
请设计一个简单实验说明溶液变浅的主要原因 。
41.某实验小组设计了下列装置进行氨的催化氧化实验。
(1)实验时发现:如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,则烧瓶中先产生白雾,随即产生白烟,其原因可用化学方程式表示为: 、 。
(2)实验前,烧杯中盛有200mL 1.000 mol/L NaOH溶液,实验后将烧杯中溶液蒸干,再将所得固体加热至恒重,得到固体10.9g,则该固体含NaOH g。
(13分)实验室以含有少量铁的粗铜粉和硫酸与硝酸的混合溶液为原料制备CuSO4·5H2O(胆矾)晶体。设计的工艺流程图如下:
请回答下列问题:
(1)根据反应原理,操作①所需的混酸溶液中硝酸和硫酸的理论配比(物质的量之比)为________。操作②中需要把NO与_____气体混合通入水中,混入该气体的目的是__________________________(用化学方程式表示)。
(2)溶液I中存在一定浓度的Fe3+、Cu2+,在该浓度时生成氢氧化物沉淀的pH如下表。操作③中某学生设计物质X为H2O,若加水调整溶液pH,则Fe(OH)3开始沉淀的pH_______1.9(填“<”、“>”或“=”);而实际操作中一般不用此法调节溶液pH,其主要原因是___________________。
(3)操作④中物质Y为_______。查阅资料知CuSO4·5H2O的溶解度曲线如图所示,则操作⑤应采取的措施是蒸发浓缩、______________、过滤、洗涤、干燥等。
(4)为测定胆矾中结晶水的数目,称取25.0g胆矾品体在坩埚中加热,固体质量随温度升高而变化的曲线如图。
当固体质量为8.0g时,观察到固体完全呈黑色。请列式计算开始称取的胆矾中结晶水的数目。
(12)下图中的每一方框内表示一种反应物或生成物,其中A、C、D、E、F在通常情况下均为气体,且A与C物质的量之比为1:1。B为常见液体。
试回答下列问题:
(1)X是 ;F是 (都填化学式)。
(2)A D反应的化学方程式 。
D反应的化学方程式 。
(3)G与Cu的反应中,G表现得性质有 。
(4)X与过量NaOH溶液反应(加热)的离子方程式 。
(5)以C、B、D为原料可生产G,若使a mol C 完全转化为G,理论上至少需要D mol。
某化肥厂以氨和空气(其中氧气的体积分数为0.2)为原料生产硝酸铵过程如下:
(1)步骤②发生了两个反应,将这两个化学方程式合并为一个化学方程式,可表示为 。
(2)若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中氨(包括第③步被硝酸吸收的氨)的体积分数最大值为 。
(3)假设实际生产中,反应①、②中含氮物质的利用率分别为a、b,反应③中氨的利用率为c,硝酸的利用率为100%,则合成硝酸铵的整个流程中,氨的总利用率是 。(用含a,b,c的表示式)。
(7分,除方程式外每空1分)A、B、C是中学化学中常见的三种短周期元素。
已知:①A元素原子最外层电子数是次外层电子数的2倍;②B元素最高正价与最低负价的代数和为2;③C元素有多种化合价,且常温下C元素的单质与某种一元强碱溶液反应,可得到两种含C元素的化合物;④B、C两种元素质子数之和是A元素质子数的4倍。
(1)写出常温下C的单质和强碱溶液反应的离子方程式___________________。
(2)意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的B4气态分子。B4分子结构与白磷分子结构相似 ,已知断裂1 mol B—B键吸收167 kJ的热量,生成1 mol B≡B键放出942 kJ热量。试判断相同条件下B4与B2的稳定性顺序是:_ _ 。
,已知断裂1 mol B—B键吸收167 kJ的热量,生成1 mol B≡B键放出942 kJ热量。试判断相同条件下B4与B2的稳定性顺序是:_ _ 。
(3)由B、C两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形分子,且分子里B、C两种原子最外层均达到8个电子的稳定结构。X遇水蒸气可形成一种常见的漂白性物质。则X与水反应的化学方程式是___________________。
(4)A、B两种元素可形成一种硬度比金刚石还大的化合物Y。在化合物Y中,A、B原子间以单键相结合,且每个原子的最外层均达到8个电子的稳定结构。则Y的化学式为_____________,其熔沸点比金刚石_____(填“高”、“低”或“无法比较”)。
(本题14分)
合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)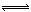 2NH3(g)+Q(Q>0)
2NH3(g)+Q(Q>0)
一种工业合成氨的简易流程图如下: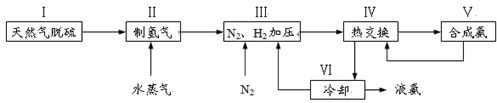
完成下列填空:
28.天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生。NH4HS的电子式是_______________,写出再生反应的化学方程式:_______________。NH3的沸点高于H2S,是因为NH3分子之间存在着一种比_________力更强的作用力。
29.室温下,0.1 mol/L的氯化铵溶液和0.1 mol/L的硫酸氢铵溶液,酸性更强的是_______,其原因是_______。
已知:H2SO4:Ki2=1.2×10-2 NH3·H2O:Ki=1.8×10-5
30.图甲表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:______(答案用小数表示,保留3位有效数字)。
31.依据温度对合成氨反应的影响,在图乙坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。

32.上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。
简述本流程中提高合成氨原料总转化率的方法:________________________________。
ⅠPM2.5是连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol•L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断PM2.5试样的pH 。
(2)NOx汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
则N2和O2反应生成NO的热化学反应方程式为
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下: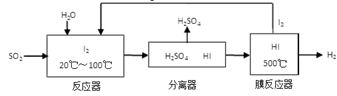
①用离子方程式表示反应器中发生的反应:
②将生成的氢气与氧气分别通入两个多孔惰性电极,KOH溶液作为电解质溶液,负极的电极反应式_ _
Ⅱ铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。
在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
(1)检验滤液B中是否还含有铁元素的方法为: (注明试剂、现象)。
(2)将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为 (填代号)。
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
(3)由滤液B制备氯化铝晶体涉及的操作为: 蒸发浓缩、冷却结晶、 、洗涤。
(4)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填代号)。
(本题9个空,每空2分,共18分)
Ⅰ、碳元素是日常生活中接触非常多的一种元素,回答下列问题。
(1)用化学方程式表示溶洞生成的反应原理: 。
(2)可用稀盐酸来鉴别Na2CO3和NaHCO3溶液,现将稀盐酸慢慢滴入碳酸钠溶液中,请写出开始阶段发生反应的离子方程式 。
(3)写出用小苏打来治疗胃酸过多时发生反应的离子方程式: 。
Ⅱ、氮元素在生命活动中扮演着重要的角色,回答下列与氮及其化合物有关的问题:
(1)德国化学家哈伯、波施等科学家成功地开发了将氮气转化为氨气的生产工艺。请用化学方程式表示工业合成氨的反应原理: 。写出在氨气的出气口处,检验有氨气生成的操作: 。
(2)将氨气通入酚酞溶液中,酚酞溶液变成红色。请用方程式解释原因式: 。
Ⅲ、印刷电路板是由塑料和铜箔复合而成,刻制印刷电路时要用FeCl3溶液作为“腐蚀液”溶解铜。
(1)写出该反应的离子方程式: ;
(2)从使用过的腐蚀液中可以回收金属铜,下列试剂能实现的是 (填序号)
| A.氯气 | B.铁 | C.硝酸 | D.稀硫酸 |
(3)向使用过的腐蚀液中通入Cl2,可使Fe2+转化为Fe3+,写出反应的离子方程式 。
(14分) NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:2NaNO2+4HI===2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是________。
(2)根据上述反应,鉴别NaNO2和NaCl。可选用的物质有:①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋,你认为必须选用的物质有________(填序号)。
(3)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是________(填编号)。
| A.NaCl | B.NH4Cl | C.HNO3 | D.浓H2SO4 |
(4)请完成并配平以下化学方程式:
□Al+□NaNO3+□NaOH===□NaAlO2+□N2↑+□ 。
若反应过程中转移5 mol e-,则生成标准状况下N2的体积为________L。
(5)在微生物作用的条件下, NH4+经过两步反应被氧化成NO3ˉ。两步反应的能量变化示意图如下:
①第一步反应是 反应(填“放热”或“吸热”),
②1mol NH4+(aq)全部氧化成NO3ˉ(aq)的热化学方程式是: 。
(8分)磷元素有多种化合价(-3、0、+1、+3、+5)。次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元弱酸,写出其电离方程式: _____________________
(2)H3PO2可将溶液中的银离子还原为银单质,从而可用于化学镀银。
①H3PO2中,磷元素的化合价为
②利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4︰1,则氧化产物为:
③写出H3PO2与足量氢氧化钠溶液反应的离子方程式:
(3)将白磷(P4)与氢氧化钡溶液反应生成PH3气体和Ba(H2PO2)2 ,写出白磷与氢氧化钡溶液反应的化学方程式:
有下列转化关系(反应条件略):
已知:① X、Y、Z、W均为氧化物。常态下,X是红棕色气体;Y能使澄清石灰水变浑浊但不能使品红溶液褪色。② 相对分子质量:甲﹤乙。③ 将甲的浓溶液露置在空气中一段时间,质量减小浓度降低;将乙的浓溶液露置在空气中一段时间,质量增加浓度降低。请填写下列空白:
(1)Z的化学式: 。
(2)将乙的浓溶液露置在空气中一段时间,质量增加浓度降低,反映出乙的浓溶液具有 性。利用这种性质可以进行 项(填字母)实验操作。
a.钝化铁片 b.检验Ba2+离子 c.干燥氨气 d.干燥氯气
(3)在X和Z的反应中,被氧化的X与被还原的X的物质的量之比是: 。
(4)W可用于工业制溴过程中吸收潮湿空气中的Br2 ,写出该反应的化学方式: 。
(5)写出M与甲的浓溶液在加热条件下反应的化学方程式: 。
试题篮
()