银铜合金广泛应用于航空工业。从切割废料中回收银并制备铜的化工产品工艺如下:
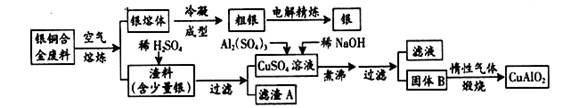
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为 。
(2)固体混合物B的组成为 ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为 。
(3)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为____mol CuAlO2(Cu 的相对原子量取63.5),至少需要1.0mol·L-1的Al2(SO4)3溶液 L。
(6分)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO的浓度,某兴趣小组提出以下两种方案:
a.在微碱性条件下,用Fe(OH)2还原NO3-,还原产物为NH3;
b.在碱性条件下,用铝粉还原NO3-,还原产物为N2。
(1)方案a中,生成34g NH3的同时生成__________mol Fe(OH)3。
(2)方案b中发生的反应如下(配平该反应离子方程式):
______Al+______NO3-+______OH-===______AlO2-+______N2↑+______H2O
(3)方案b中,当有0.15 mol电子转移时,生成的氮气在标准状况下的体积为_________mL。
NH3经一系列反应可以得到HNO3和NH4NO3,如下图所示。
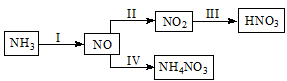
(1)I中,NH3和O2在催化剂作用下反应,其化学方程式是 。
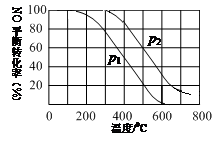
(2)II中,2NO(g)+O2(g) 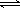 2NO2(g) 。起始时容器充入1molNO、0.5molO2,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如下图)。
2NO2(g) 。起始时容器充入1molNO、0.5molO2,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如下图)。
①比较p1、p2的大小关系 。
②在温度为500℃、压强为p2条件下,平衡混合气中NO2的体积分数 。
(3)III中,将NO2(g)转化成N2O4(l),再制备浓硝酸。
①已知:2NO2(g) 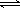 N2O4(g) ΔH1 2NO2(g)
N2O4(g) ΔH1 2NO2(g) 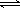 N2O4(l) ΔH2
N2O4(l) ΔH2
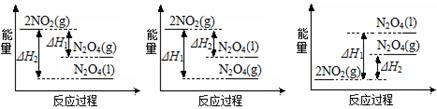
A B C
反应过程中能量变化正确的是 (填序号)。
②N2O4与O2、H2O化合的化学方程式 。
HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+.AgNO2是一种难溶于水、易溶于酸的化合物.试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+.若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为 Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是____________(填序号)。
A.亚硝酸盐被还原
B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+
D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是____________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI-淀粉溶液来区别
D. 用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:____________________。
(4)Fe与过量稀硫酸反应可以制取FeSO4.若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是___________(填序号)。
a.Cl2 b.Fe c.H2O2 d.HNO3
(5)若FeSO4和O2的化学计量数比为2:1,试配平下列方程式:
FeSO4+ K2O2→ K2FeO4+ K2O+ K2SO4+ O2↑
(6)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体.高铁酸钾作为水处理剂发挥的作用是______________________。
14分)氮是一种重要的非金属元素,可以形成多种不同类型的化合物,请根据要求回答下列问题:
(1)NA表示阿伏加德罗常数的数值。69g NO2和N2O4的混合气体中含有____________NA个氧原子;2L 0.6 mol/LFe(NO3)3溶液中含________NA个NO3-离子。
(2)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,
①写出该反应的化学方程式 若反应中生成0.15 mol HNO3,转移的电子数目为________个.
②三氟化氮可由氨气和氟气反应得到:4NH3+3F2=NF3+3NH4F;据题意推测NF3、F2、NO三种气体中,氧化性由强到弱的顺序为________________________
③NF3是一种无色、无臭的气体,一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有___________________(填化学式).
(3)氨和联氨(N2H4)是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式 。
氮是一种重要的元素,在很多物质中都含有它的身影。
I.在9.3胜利日阅兵活动中,我国展示了多款导弹,向世界展示了我们捍卫和平的决心和能力。偏二甲肼【(CH3)2NNH2】是一种无色易燃的液体,常与N2O4作为常用火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 (l )+2N2O4 (l)=2CO2 (g)+3N2(g)+4H2O(g)
(1)该反应(Ⅰ)中氧化剂是_____________。
(2)火箭残骸中常现红棕色气体,原因为:N2O4 (g)  2NO2 (g),一定温度下,该反应的焓变为ΔH。现将2 mol NO2 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是_________。
2NO2 (g),一定温度下,该反应的焓变为ΔH。现将2 mol NO2 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是_________。
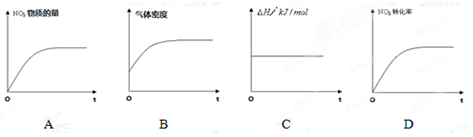
若在相同温度下,将上述反应改在体积为2L的恒容密闭容器中进行,平衡常数____________(填“增大”“不变”或“减小”),反应4min后N2O4的物质的量为0.8mol,则0~4min内的平均反应速率v(NO2)=_________________。
II.硝酸铵(NH4NO3)是一种重要的铵盐,它的主要用途作肥料及工业用和军用炸药。在25℃时,将1mol 硝酸铵溶于水,溶液显酸性,原因是 (用离子方程式表示)。向该溶液滴加50mL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将__________(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为___________mol·L-1。(NH3·H2O的电离平衡常数Kb=2×10-5 mol·L-1)
焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和X。
(1)根据题意,可判断出X是________(写化学式)。
(2)写出并配平该反应的化学方程式:_________________________;
(3)发生还原反应的物质是________,反应中2mol的氧化剂能___________(填“失去”或“得到”)_________mol电子。
(4)反应中被氧化产生了5.6L(标准状况)的气体时,被还原的物质的质量为____________。
“8·12”天津港危化仓库爆炸,造成生命、财产的特大损失。据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN)。请回答下列问题:
(1)钠、钾着火,下列可用来灭火的是 。
A.水 B.泡沫灭火器 C.干粉灭火器 D.细沙盖灭
(2)NH4NO3为爆炸物,在不同温度下加热分解,可能发生非氧化还原反应,
可能发生氧化还原反应,下列反应可能发生的是 。
A.NH4NO3 → N2 + O2 + H2O
B.NH4NO3 → NH3 + HNO3
C.NH4NO3 → O2 + HNO3 + H2O
D.NH4NO3→ N2 + HNO3 +H2O
E.NH4NO3→N2+ NH3+ H2O
F.NH4NO3 →N2O + H2O
(3)NaCN属于剧毒物质,有多种无害化处理方法。
①H2O2处理法:NaCN + H2O2 —— N2↑+ X + H2O推测X的化学式为 。
② NaClO处理法:aCN-+bClO-+2cOH-= dCNO-+eN2↑+fCO32-+bCl-+cH2O
方程式中e : f的值为 (填选项标号)。
A.1 B.1/2 C.2 D.不能确定
(4)以TiO2为催化剂用NaClO将CN-离子氧化成CNO-,CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等。取浓缩后含CN-离子的废水与过量NaClO溶液的混合液共200mL(设其中CN-的浓度为0.2mol·L—1)进行实验。
①写出CNO-在酸性条件下被NaClO氧化的离子方程式:______________;
②若结果测得CO2的质量为1.408g,则该实验中测得CN-被处理的百分率为 。
(1)向NH4Cl、AlCl3、MgCl2混合溶液中逐滴加入NaOH至过量,按反应的先后顺序,写出有关的离子方程式:
①______________________________
②______________________________
③______________________________
(2)含硫化合物的种类很多,常见的有:SO2、Na2SO4、H2SO4、CuSO4等。
① 向含FeCl3和BaCl2的酸性溶液中通入SO2,有白色沉淀生成,此沉淀是_____________
② 我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来减少SO2的污染,写出该反应的化学方程式_______________________
③ Na2SO3和KIO3在酸性溶液中发生的反应叫碘酸盐型“碘钟”反应,常用淀粉作指示剂,写出KIO3过量时该氧化还原反应的离子方程式_______________________
(3) 实验室用固体烧碱配制500 mL 0.1 mol•L―1的NaOH溶液。
① 需称量________g的烧碱固体,它应该盛放在________中进行称量。
② 配制过程中,不需要使用的仪器是(填写代号)________。
A 烧杯 B 漏斗
C 1000 mL容量瓶 D 托盘天平
E 药匙 F 500 mL容量瓶 G 胶头滴管
③ 除上述可使用的仪器,还缺少的仪器是________,在实验中的作用___________。
下面是中学化学中常用的玻璃仪器组成的实验装置图(根据需要可在广口瓶中加入液体)。
下面是中学化学中常用的玻璃仪器组成的实验装置图(根据需要可在广口瓶中加入液体或在干燥管中放入固体)。
请回答下列问题:
(1)用装置A收集NH3气体,气体应从_________________(填“①”或“②”)处通入。
(2)若用装置B做二氧化硫与烧杯中氢氧化钠溶液反应的实验,则其中广口瓶能否起到防倒吸作用(填“能”或“不能”)______________________。
(3)用C来收集NO2气体,最终得不到NO2,其发生反应的化学方程式为:___________________。
(本题共14分)氮是一种重要的非金属元素,可以形成多种不同类型的化合物,请根据要求回答下列问题:
(1)NA表示阿伏加德罗常数的数值。69g NO2和N2O4的混合气体中含有____NA个氧原子;2L 0.6 mol/LFe(NO3)3溶液中含_____NA个NO3-离子。
(2)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,
① 写出该反应的化学方程式 .若反应中生成0.15 mol HNO3,转移的电子数目为________个.
②三氟化氮可由氨气和氟气反应得到:4NH3+3F2=NF3+3NH4F;据题意推测 NF3,F2,NO三种气体中,氧化性由强到弱的顺序为
③NF3是一种无色、无臭的气体,一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有__________________(填化学式).
(3)氨和联氨(N2H4)是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式 。
利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如下:

(1)一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g) N2O3(g),其平衡常数表达式为K=
N2O3(g),其平衡常数表达式为K=
(2)上述工艺中采用气液逆流接触吸收(尾气从吸收塔底部进入,石灰乳从吸收塔顶部喷淋),其目的是 ;滤渣可循环利用,滤渣的主要成分是 (填化学式)。
(3)该工艺需控制NO和NO2物质的量之比接近1:1,写出该工艺的化学反应方程式 ;若n(NO) :n(NO2)>1:1,则会导致 ;若n(NO) :n(NO2)<1:1,则会导致 。
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式 。
查资料得:HNO2是一种弱酸且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)下列方法中,不能用来区分NaNO2和NaCl的是_______________(填序号)。
A.测定这两种溶液的pH B.用AgNO3和HNO3两种试剂来区别
C.在酸性条件下加入KI-淀粉溶液来区别 D.分别在两种溶液中滴加甲基橙
(2)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是_____________(填序号)。
A.Cl2 B.H2O2 C.KMnO4 D.HNO3
(3)某同学把酸性高锰酸钾溶液滴入NaNO2溶液中,观察到紫色褪去,同时生成NO3-和Mn2+,请写出反应的离子方程式:________________。
(4)已知FeSO4在一定条件下可转变为高铁酸钾(K2FeO4),高铁酸钾是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体。高铁酸钾作为水处理剂发挥的作用是______________。
氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 L H2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25 g/L。请回答下列问题:
(1)甲的化学式是_________;乙的电子式是__________。
(2)甲与水反应的化学方程式是______________。
(3)气体丙与金属镁反应的产物是_______(用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式 。
(5)甲与乙之间可能发生反应产生H2,理由是____________。
试题篮
()