(1)滑石一种硅酸盐矿物,其化学式为Mg3Si4O10(OH)2,用氧化物的形式表示为 。
(2)除去下列物质中所含杂质(括号内为杂质),写出除去杂质的试剂。
①Fe2O3(Al2O3) ②NO(NO2)
③Cl2 (HCl) ④FeCl3 (FeCl2)
(3)用铝箔包裹0.1mol金属钠,用针扎若干小孔,放入水中,完全反应后,用排水取气法收集到标准状况下气体的体积是_________(填字母序号)
a.1.12L b.>1.12L c.<1.12L
化学与环境密切相关.近年来雾霾问题已成为百姓所关注的主要问题,今年入秋以来,我国大部分地区更是“霾伏”四起,部分地区持续出现中度至重度霾,环境治理刻不容缓。回答下列问题:
(1)下列有关说法正确的是
A.光化学烟雾是氮氧化物与碳氢化合物受紫外线作用后产生的有毒烟雾
B.PH小于7的雨水都是酸雨
C.PM2.5含量的增加是形成雾霾天气的重要原因之一
D.大气中CO2含量的增加会导致臭氧空洞的加剧
(2)某化学实验小组测得某地区的雾霾中可能含有如下几种无机离子:Na+、NH4+、Mg2+、Al3+、SO42﹣、NO3﹣、Cl﹣.对该地区雾霾处理后获得试样溶液进行了如下的实验:
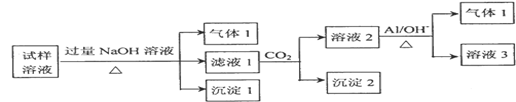
已知:3NO3﹣+8Al+5OH﹣+18H2O═3NH3↑+8[Al(OH)4]﹣
请回答下列问题:
①试样溶液加入过量NaOH溶液后生成沉淀Ⅰ的化学式是 .生成气体Ⅰ的离子方程式为 ,检验该气体的方法是 。
②根据实验结果,推测出雾霾中一定含有的离子有 ,若要确定原试样溶液存在的其它阴离子,可在试样溶液中先加入足量的 溶液,再取上层清液加入 溶液。
(3)若该实验小组测得另一地区雾霾试样中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32﹣、Cl﹣、NO3﹣中的几种.①若加入锌粒,排空法收集到无色无味气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间关系如图所示.则下列说法不正确的是

A.溶液中一定不含CO32﹣,可能含有SO42﹣和Cl﹣
B.溶液中n(Mg2+)=0.1mol
C.溶液中的阴离子的物质的量为0.35mol
D.n(H+):n(Al3+):n(Mg2+)=1:1:1
将128g铜置于一定量的浓硝酸中并微热。当铜片完全消失时,共收集到NO2和NO的混合气体44.8L(标准状况下)。
(1)写出上述过程中,有关反应的离子方程式______________、_____________。
(2)完成该反应至少需要量取10mol/L的浓硝酸__________mL。
(3)混合气体中NO2的体积为__________L,NO的体积为__________L(均为标准状况下)。
(4)将收集上述气体的容器倒扣在盛有水的水槽中,并向其中缓慢通入O2使其充分反应,若要使溶液恰好充满容器,则理论上需要参加反应的O2的物质的量为____________mol。
将V mL NO和NO2的混合气体通过足量的水,充分反应后,得到一定体积的无色气体A。将此无色气体A与等体积的氧气混合,充分反应后,再通过足量的水,充分反应后还能收集到5 mL无色气体(以上气体体积均在相同状况下测定)。试回答:
(1)A是 ,其体积为 mL。
(2)反应过程中涉及的化学方程式:
NO分子曾因污染空气而臭名昭著,但随着其“扩张血管、免疫、增强记忆”功能的发现,现在成为当前生命科学研究中的“明星分子”,回答下列问题:
(1)NO的危害在于 。
a.破坏臭氧层 b.参与酸雨和光化学烟雾的形成
c.与人体内血红蛋白结合 d.当它转化为N2后使空气中O2含量降低
(2)NH3与氧气反应可生成NO,化学方程式为 ;若参加反应的NH3为6 mol,则反应中转移了__________mol电子。
(3)一定条件下NO可转化为N2O和另一种红棕色气体,化学方程式为 。
(4)将0.05molNO和0.03molO2气体混合再以适当的速率缓慢通入盛有100mL水的集气瓶中,最终所得溶液中溶质的物质的量浓度为(设溶液体积变化忽视不计) 。
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属铜反应的情况,回答下列问题:
(1)稀盐酸不与Cu反应,若在稀盐酸中加入H2O2(常见氧化剂,作氧化剂时还原产物为水)后,则可使铜顺利溶解.该反应的化学方程式为: .
(2)在一定体积的10mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol.则浓硫酸的实际体积 (填“大于”、“等于”或“小于”)180mL.若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为 .
(3)镁铁混合物4.9g,溶解在过量的某浓度的稀硝酸中,完全反应后得到标准状况下2.24L NO 气体.若向反应后的溶液中加入足量的烧碱,则可生成沉淀的质量是 .
氮氧化物进入大气后,可能会形成硝酸型酸雨,因此必须对含有氮氧化物的废气进行处理。
(1)用NaOH可以吸收废气中的氮氧化物,反应的化学方程式如下:2NO2 + 2NaOH  NaNO2 + NaNO3 + H2O 反应中,还原剂是 ,NO2 + NO + 2NaOH
NaNO2 + NaNO3 + H2O 反应中,还原剂是 ,NO2 + NO + 2NaOH  2NaNO2 + H2O 反应中,氧化产物和还原产物之比为 。
2NaNO2 + H2O 反应中,氧化产物和还原产物之比为 。
(2)NO2和Br2蒸汽都是红棕色气体,下列可以用来鉴别这两种气体的试剂是 。
| A.用氢氧化钠溶液 | B.淀粉碘化钾溶液 | C.用硝酸银溶液 | D.用蒸馏水 |
(3)汽车尾气中含有一氧化氮和一氧化碳,消除这两种物质对大气污染的方法是安装催化转化器,使它们发生反应生成两种对大气无污染的气体,该反应的化学方程式为 。
(4)氨气也可用来处理氮氧化物,例如:氨气与二氧化氮反应生成氮气和水,写出该反应的化学方程式: ,若某工厂排出的废气中二氧化氮含量为0.5%(体积分数),处理1000m3(标准状况)这种废气,需要 千克氨气。(结果保留两位小数)
(1)地壳中含量最高的金属是 ,NaHCO3俗称 ,制造计算机芯片的半导体材料是 ,水晶项链的主要成分是 。
(2)在反应3Cu+8 HNO3(稀)="=" 3Cu(NO3)2+2NO↑+4H2O中,失去电子的是_________(填元素符号),被还原的是_______(填元素符号)。当产生标况下4.48 L气体时消耗单质铜 g,此时转移了_______ mol电子。
现有一定量铝粉和铁粉的混合物与一定体积稀硝酸充分反应,反应过程中无气体放出(硝酸的还原产物是NH4NO3)。在反应结束后的溶液中,逐滴加入2mol∙L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量的关系如图所示。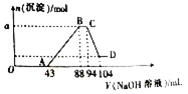
(1)写出OA段反应的离子方程式:____________________________。
(2)B点时溶液中含有溶质的化学式为____________。
(3)a的数值为__________。
(4)原硝酸溶液中HNO3的物质的量为__________mol。
NO、NO2、NH3、SO2、CO等都是空气污染物。
(1)酸雨的形成主要是大气中的_________溶于水后形成了酸性溶液。
(2)在汽车的排气管上装一个催化转化装置,可使汽车尾气中的NO与CO反应,生成氮气和碳的另一种无污染的气体,请完成该转化的化学方程式: NO + CO—N2+ 。
氯碱工业生产中用氨气检查氯气管道是否泄漏,氨气遇到氯气会产生白烟,
(1)反应还生成了一种无毒的气态单质,写出反应的化学方程式 ________________________。
(2)在该反应中,氧化剂是____________,还原产物是____________,当有1.7g的氨气参与反应时,转移的电子数目为____________。
(3)列式计算当有112 mL的氯气(已折算到标准状况)参加反应时生成白烟的质量为________ g。
氮及其化合物之间可以互相转化,请按照要求回答下列问题:
(1)实验室制取氨气。
① 实验室制取氨气的反应原理是利用了 类物质与 类物质的反应。
② 可用向下排空气法收集氨气的原因是 。
③ 用水吸收多余的氨气时,如将导管直接插入水中, 会产生倒吸现象,产生该现象的原因是 。
(2)完成下列能生成NO的化学方程式:
① 体现N元素的还原性:氨的催化氧化:____________。
② 体现N元素的氧化性:____________。
某些化学反应可表示为: A + B → C + D+H2O(未注明反应条件)请回答下列问题:
(1)若A、C、D均含氯元素,且A的化合价介于C与D之间,写出该反应的离子方程式:
。
(2)若A为紫红色金属,D为红棕色气体,请写出该反应的化学方程式:
。
(3)若A为不含金属元素的盐,B为碱,则检验气体C的方法是: 。
(4)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B的组合是 。
除去下表内各物质中含有的少量杂质,写出除杂试剂,并填写分离方法。
| 序号 |
物质 |
杂质 |
所加试剂 |
分离方法 |
| (1) |
NO |
NO2 |
|
|
| (2) |
Fe粉 |
Al粉 |
|
|
| (3) |
氯化钠固体 |
氯化铵固体 |
|
|
试题篮
()