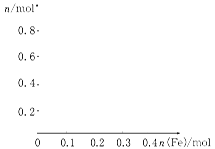
向含有0.8 mol的稀硝酸中慢慢加入22.4 g的铁粉,假设反应分为两个阶段。
第一阶段为:Fe+HNO3(稀)→Fe(NO3)3+NO↑+H2O
(1)写出这两个阶段发生反应的离子方程式:
第一阶段: 。
第二阶段: 。
(2)在图中画出溶液中Fe2+、Fe3+、NO3-的物质的量随加入铁粉的物质的量变化的关系图象(横坐标为加入铁粉的物质的量,纵坐标是溶液中离子的物质的量)。
工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下:
(1)已知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式:____________。
当温度降低时,化学平衡常数K值________(填“增大”、“减小”或“无影响”)。
(2)氨气是制取硝酸的重要原料,合成氨反应的化学方程式如下:N2+3H2 2NH3,该反应在固定容积的密闭容器中进行。
2NH3,该反应在固定容积的密闭容器中进行。
①下列各项标志着该反应达到化学平衡状态的是________(填字母)。
| A.容器内N2、H2、NH3的浓度之比为1∶3∶2 |
| B.v正(N2)=v逆(H2) |
| C.容器内压强保持不变 |
| D.混合气体的密度保持不变 |
②若在恒温条件下,将N2与H2按一定比例混合通入一个容积为2 L固定容积的密闭容器中,5 min后反应达平衡时,n(N2)=1.0 mol,n(H2)=0.8 mol,n(NH3)=0.8 mol,则反应速率v(H2)=________,平衡常数=________。
③若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将 (填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度 (填“大于”、“小于”或“等于”)原来的2倍。
氯化亚铜(
)广泛应用于化工、印染、电镀等行业。
难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是
和少量
)为原料,采用硝酸铵氧化分解技术生产
的工艺过程如下: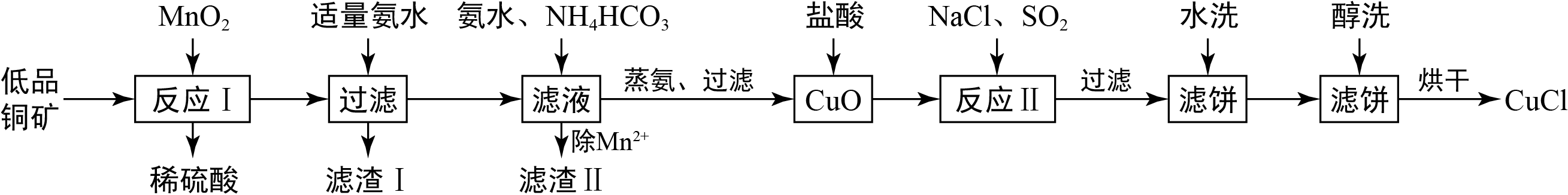
回答下列问题:
(1)步骤①中得到的氧化产物是,溶解温度应控制在60~70度,原因是。
(2)写出步骤③中主要反应的离子方程式。
(3)步骤⑤包括用
=2的酸洗、水洗两步操作,酸洗采用的酸是(写名称)。
(4)上述工艺中,步骤⑥不能省略,理由是 。
(5)步骤②、④、⑤、⑧都要进行固液分离。工业上常用的固液分离设备有(填字母)
| A. | 分馏塔 | B. | 离心机 | C. | 反应釜 | D. | 框式压滤机 |
(6)准确称取所制备的氯化亚铜样品 ,将其置于若两的 溶液中,待样品完全溶解后,加入适量稀硫酸,用 的 溶液滴定到终点,消耗 溶液 ,反应中 被还原为 ,样品中 的质量分数为。
氮元素的单质及化合物在工农业生产中有重要应用。
(1)①氮气用于工业合成氨,写出氮气的电子式 ;
②NH3的稳定性比PH3 (填写“强”或“弱”)。
(2)如下图所示,向NaOH固体上滴几滴浓氨水,迅速盖上盖,观察现象。
①浓盐酸液滴附近发生反应的化学方程式为 。
②浓硫酸液滴上方没有明显现象,一段时间后浓硫酸的液滴中有白色固体,该固体可能是 (写化学式,一种即可)。
③FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应包括Fe2+ + 2NH3·H2O= Fe(OH)2↓+ 2NH4+ 和 _______ 。
(3)将SO2气体通入氯化钡溶液,未见有沉淀生成,继续通入NH3,则出现白色沉淀,请写出反应的离子方程式______________________________________;若将SO2气体通入酸化的硝酸钡溶液,也产生白色沉淀,用离子方程式加以说明 。
(4)氮氧化物的排放会对空气造成污染,利用氧化法除去烟气中的氮氧化物。首先向氮氧化物中补充氧气,然后将混合气体通入石灰乳中,使之转化为硝酸钙。
已知某氮氧化物由NO和NO2组成,且n(NO):n(NO2)=1:3
写出氧化吸收法除去氮氧化物的化学方程式___________________。
(5)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),反应的化学方程式为 _________ ,若反应中有3 mol电子发生转移时,生成亚硝酸的质量为 g。
(8分) “低碳”既是时尚,也是环保要求。“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂今后联合生产等都是很好的“低碳”生产方式。下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺:
请回答下列问题:
(1)工艺操作②为:____________。
(2)工业合成氨的化学方程式为:____________________。
(3)副产品的化学式为_________。该联合生产工艺中可以循环使用的物质是_________________。
(4)在实验室中检验合成氨厂排出的废气中是否含有氨气的方法是______________________。
(5)写出生成“产品”的化学方程式:_______________________
(16分)用芒硝(Na2SO4·10H2O)制备纯碱、铵明矾[NH4Al(SO4)2·12H2O]的生产工艺流程图如下所示:
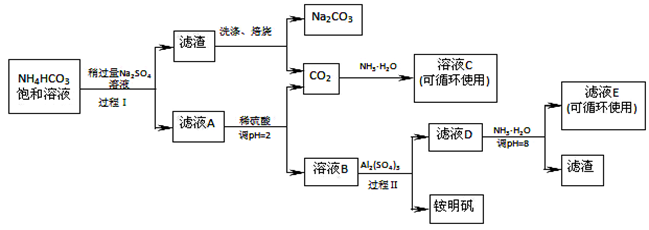
(1)溶液C中的溶质主要是 。
(2)铵明矾的溶液呈 性,铵明矾可用于净水,用离子方程式说明原理 。
(3)过程Ⅰ反应温度不能超过40℃,主要原因是 。
(4)运用化学平衡原理解释Na2SO4溶液稍过量的原因
(5)滤液E中溶质离子为
(6)写出工艺流程中焙烧的反应方程式
化学肥料在农业生产中有重要作用。农业生产中,大量施用的化肥主要是氮肥、磷肥、钾肥。
(1)普钙是磷肥,它的有效成分是__________________(写化学式)。
(2)尿素是一种含氮量较高的氮肥,工业生产尿素是将氨气与二氧化碳在加压、加热的条件下反应生成氨基甲酸铵(H2NCOONH4),再使氨基甲酸铵脱水得到尿素。反应的化学方程式为_________、___________。
(3)某化肥厂用NH3制备NH4NO3,已知由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去NH3的质量占耗用全部NH3质量的__________%。
(4)合成氨气是生产氮肥的重要环节。合成氨生产简易流程示意图如下:
从示意图可知其存在循环操作。简要说明为什么在化工生产中经常采用循环操作___________。合成氨的反应需在500℃进行,其主要原因是_________。
试题篮
()