某溶液中可能含有OH-、CO32- 、AlO2-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+。当向该溶液中加入一定物质的量浓度的盐酸时,发现生成沉淀物质的量随盐酸的体积变化如图所示,下列说法正确的是
| A.原溶液一定含有硫酸钠 |
| B.反应最后形成的溶液中的溶质为氯化钠 |
| C.原溶液中一定含有的阴离子有OH-、CO32- 、AlO2-、 SiO32- |
| D.原溶液中含有CO32-与AlO2-的物质的量之比为1:1 |
某学生鉴定甲盐的流程如图所示,下列说法正确的是
| A.如果甲中含有硫离子,则乙是硫磺沉淀 |
| B.如果乙是氯化银沉淀,那么甲是氯化铁 |
| C.丙中肯定含有铁离子,所以甲是溴化亚铁 |
| D.甲中含有铁元素,可能显示+2或者+3 |
如图装置中,容器甲内充入0.1mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的9/10,随着CO2的继续通入,活塞又逐渐向右移动。(不考虑活塞的摩擦)

已知:2Na2O2+2CO2→2Na2CO3+O2
(1)已知当活塞移至C处时,干燥管中物质的质量增加了2.24g。
①此时,通入标准状况下的CO2气体为 L。
②容器甲中NO2转化为N2O4的转化率是 。
③活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处.则a值必 0.01(填大于、小于、等于),其理由是 。
(2)若改变干燥管中Na2O2的量,要通过调节甲容器的温度及通入的量CO2,使活塞发生从D到C,又从C到D的移动,则Na2O2的质量最小值应大于 g。
固体粉末X中可能含有FeO、Fe2O3、MnO2、K2SiO3、K2SO3、KAlO2、MgCl2、K2CO3、NaNO2中的若干种。为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如图所示:

根据上述实验,以下说法正确的是( )
| A.溶液甲中一定含有K2SiO3、NaNO2 |
| B.无法判断溶液中是否有K2SO3 |
| C.气体A和气体B-定为混合物 |
| D.原混合物中一定有Fe2O3 |
A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。

(1)若A是一种黄色单质固体,则B→C的化学方程式为 。
(2)若A是一种活泼金属,C是淡黄色固体,则C的名称为 。将C长期露置于空气中,最后将变成物质D。现有D和NaHCO3的固体混合物10g,加热至质量不再改变,剩余固体质量为9.38 g,D的质量分数为 。
(3)若C是红棕色气体,A可能是一种能用下图装置制取的气体,请结合所学知识,回答下列问题:

①写出实验室制取A的化学方程式 。
②收集A的方法是 ,验证A是否已经收集满的方法是:
(任写一种)。
③若有5.35g氯化铵参加反应,则产生的A气体在标准状况下的体积为 L。
右图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列反应对应的曲线错误的是
| A.向NaAlO2溶液中滴入盐酸至过量 |
| B.向澄清石灰水中通入CO2至过量 |
| C.向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量 |
| D.向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至沉淀消失 |
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入5mol/L NaOH溶液,所加的NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示,下列说法不正确的是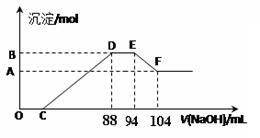
| A.稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵 |
| B.图中C点对应溶液体积为48mL |
| C.原硝酸溶液中含硝酸的物质的量为0.5mol |
| D.样品中铝粉和铁粉的物质的量之比5:3 |
向100mL pH=0的硫酸和硝酸混合溶液中投入3.84g铜粉,微热使反应充分完成后,生成NO气体448mL(标准状况)。则反应前的混合溶液中含硝酸的物质的量为
| A.0.02mol | B.0.08mol | C.0.10mol | D.0.16mol |
在1L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2mol/L和1.5mol/L,现向该溶液中加入39.2g铁粉使其充分反应。下列有关说法正确的是( )
| A.反应后溶液中Fe3+物质的量为0.8mol |
| B.反应后产生13.44L H2(标准状况) |
| C.反应后溶液中Fe2+和Fe3+物质的量之和为0.9mol |
| D.由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体 |
已知A、B、D、E、F、G、X、Y、Z满足下列转化关系。其中A、B、E为固体化合物,D、G为固体单质,F、X、Z为可燃性气体,F和X的燃烧火焰分别为蓝色和淡蓝色。

(1)写出E的名称:____________________________;
(2)B的电子式为 ;
(3)E生成Z的反应中用饱和食盐水的目的是 ;
(4)A和D反应的化学方程式:____ 。
在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断不正确的是( )
| A.在含Ba(OH)2、KOH的混合溶液中缓慢通入CO2: Ba(OH)2、KOH、K2CO3、BaCO3 |
| B.在含NH4+、Al3+、H+的溶液中逐滴加入KOH溶液:H+、Al3+、NH4+、Al(OH)3 |
| C.在含AlO2-、OH-、CO32-的溶液中逐滴加入盐酸:AlO2-、Al(OH)3、OH-、CO32- |
| D.在含等物质的量的Fe2+、Ag+、Cu2+、H+的溶液中加入锌粉:Ag+、Cu2+、H+、Fe2+ |
有一澄清透明的溶液,可能大量存在有NH4+、Fe3+、H+、Mg2+、A13+、I-、CO32-等离子。现分别取溶液进行下列实验:
(1)加人淀粉溶液,未见蓝色。
(2)加人少量AgNO3溶液有黄色沉淀和气体生成。
(3)逐滴加人1mol·L-1NaOH溶液,随着NaOH溶液的滴人,产生沉淀的量如图所示。
试确定:溶液中一定不存在的离子有________,其中阴离子物质的量为_________,加人少量AgNO3溶液的离子反应方程式为________________。
根据下图海水综合应用的工业流程图,判断下列说法正确的是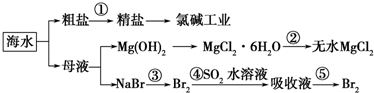
已知:MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等
| A.除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 |
| B.在过程②中将MgCl2•6H2O灼烧即可制得无水MgCl2 |
| C.从能量转换角度来看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程 |
| D.从第③步到第⑤步的目的是为了浓缩富集溴 |
如图所示,6个编号分别表示六种物质:Al、Fe2O3、NaOH溶液、氢碘酸、NH3、O2。凡是直线相连的两种物质均能发生化学反应(已知高温时氨气能还原Fe2O3。)图中⑤表示的物质是
| A.Al或Fe2O3 | B.NaOH溶液 |
| C.氢碘酸 | D.NH3或O2 |
试题篮
()