把X溶液逐滴滴入Y溶液中,与把Y溶液逐滴滴入X溶液中,反应现象不同的是
| |
A |
B |
C |
D |
| X |
NaHCO3 |
NaAlO2 |
NaHCO3 |
MgCl2 |
| Y |
Ca(OH)2 |
HCl |
HCl |
NaOH |
Ⅰ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色。
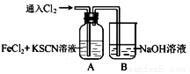
(1)B中反应的离子方程式是 ;
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验。取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在 ;
(3)资料显示:SCN -的电子式为 。甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究。
。甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究。
①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN﹣中被氧化的元素是 ;
②甲同学通过实验证明了SCN﹣中氮元素转化为NO3﹣,已知SCN﹣中碳元素没有被氧化,若SCN﹣与Cl2反应生成1mol CO2,则转移电子的物质的量是 mol;
Ⅱ.8.12天津港特大爆炸事故现场有700吨左右氰化钠,氰化钠剧毒。有少量因爆炸冲击发生泄漏。这些泄露的氰化钠可通过喷洒氧化剂双氧水的方式来处理,以减轻污染。
请写出NaCN的电子式___________,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3﹣,同时放出NH3,该反应的离子方程式为 。
下表各组物质中,物质之间通过一步反应就能实现如右图所示转化的是
| 物质选项 |
a |
b |
c |
d |
| A |
Al |
Al(OH)3 |
NaAlO2 |
NaOH |
| B |
CH3CH2OH |
CH3CHO |
CH3COOH |
O2 |
| C |
Na2CO3 |
NaHCO3 |
NaOH |
CO2 |
| D |
Cl2 |
FeCl3 |
FeCl2 |
Fe |
向100 mL的FeBr2溶液中通入标准状况下C123.36L,所得溶液中C1一和Br—的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为
| A.0.75mol·L—1 | B.1 mol·L—1 |
| C.1.5mol·L—1 | D.2mol·L—1 |
(18分)下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。
| A |
|
|
|
|
|
|
B |
| |
|
|
D |
E |
F |
|
|
| C |
|
|
|
|
G |
H |
|
(1) C的原子结构示意图为:__________________;
(2) A与G形成的化合物X的结构式为____________,其中X中含有的化学键是________
X属于_________化合物(填“离子”或“共价”)。
(3) 比较非金属性强弱:G _____ H(填“>”或“<”),用一个化学方程式表示该强弱关系_____________________________________________________________________。
(4) 在一定条件下,A与E可形成一种化合物X,其相对分子质量与O2相同,则X为______; X可在纯氧中燃烧,所得产物无污染,涉及的化学方程式为:_____________________。
(5) “神舟”六号载人飞船内需要用化合物X(由上表中的某2种元素组成)来吸收航天员呼出的CO2,请用化学方程式表示吸收原理:_______________________________。飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体为_______。
(6) E的气态氢化物与其最高价氧化物水化物反应的产物X在一定温度下分解,生成两种氧化物,每1 mol X分解时转移的电子为4 mol,X受热分解的化学方程式为_______
已知A、B、C、D、E、F、G为中学化学中常见的化合物,其中A是淡黄色固体,B是无色液体,G为红褐色沉淀。常温下甲、乙、丙为气态非金属单质,丙呈黄绿色;丁、戊为常见金属单质,其中戊是当前用量最大的金属。它们之间的转化关系如下图所示(有的反应部分产物已经略去)。请根据以上信息回答下列问题:

(1)写出下列物质的化学式:A ,E 。
(2)写出丁所含元素在周期表中的位置 。
(3)在实验室中,欲检验F溶液中的金属阳离子,先向溶液中滴加几滴 溶液,再加入几滴氯水,观察到溶液变为 色,证明原溶液中的金属阳离子为 。
(4)F转化为G的化学方程式: 。
(5)写出②中反应的离子方程式: 。
有50mL某气体,可能含有CO2、O2、NH3中的一种或几种,将其通过浓H2SO4没有发现体积变化。通过足量Na2O2后,体积变为30mL,则该气体可能为( )
| A.CO2为20mL,NH3为30mL | B.NH3为40mL,O2为10mL |
| C.CO2为30mL,O2为20mL | D.CO2为40mL,O2为10mL |
一定条件下A、B、C有如图所示的转化关系,且△H=△H1+△H2 符合上述转化关系的A、C可能是

①Fe、FeCl3 ②C、CO2 ③AlCl3、NaAlO2 ④NaOH、NaHCO3 ⑤S、SO3 ⑥Na2CO3、CO2
A.只有②③④⑥ B.除①外 C.除⑤外 D.全部
大多数非金属元素有含氧酸根离子,某些金属元素也有含氧酸根离子:
MnO4-、MnO42-、Cr2O72-等。某无机盐M是一种优良的氧化剂,为确定其化学式,某小组设计并完成了如下实验:
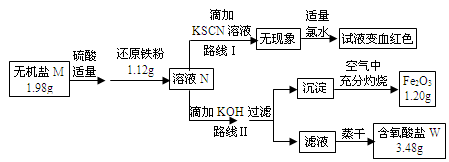
已知:
①无机盐M仅由钾离子和一种含氧酸根组成,其原子个数比为2:1:4
②如图中,将1.98g该无机盐溶于水,滴加适量稀硫酸后,再加入1.12g还原铁粉,整个过程无气体生成,恰好完全反应得混合溶液N.
③该小组同学将溶液N分为二等份,分别按路线Ⅰ、路线Ⅱ进行实验.
④在路线Ⅱ中,首先向溶液N中滴加适量KOH至元素X刚好沉淀完全,过滤后将沉淀在空气中充分灼烧得纯净的Fe2O3粉末1.20g;再将滤液在一定条件下蒸干,只得到3.48g纯净的不含结晶水的正盐W.
请按要求回答下列问题:
(1)由路线Ⅰ的现象可知,溶液N中含有的阳离子是 .
(2)由实验流程图可推得,含氧酸盐W的化学式是 ;由路线Ⅱ可知,1.98g无机盐M中所含钾元素的质量为 g.
(3)无机盐M与1.12g还原铁粉恰好完全反应生成溶液N的化学反应方程为 .
向含FeCl3、FeCl2、AlCl3、NaCl的溶液中,加入足量的Na2O2固体后,再加入过量的稀盐酸,溶液中离子数目不发生变化的是
| A.Na+ | B.Al3+ | C.Fe3+ | D.Fe2+ |
对溶液中的反应,如图像中m表示生成沉淀的物质的量,n表示参加反应的某一种反应物的物质的量,则下列叙述中错误的是:
| A.符合甲图像的两种反应物可以是AlCl3和NaOH |
| B.符合乙图像的两种反应物可以是Ca(OH)2和CO2 |
| C.符合丙图像的反应可以是在Ca(OH)2和KOH的混合溶液中通入CO2 |
| D.符合丙图像的反应可以是在NH4Al(SO4)2溶液中加入NaOH |
右图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列反应对应的曲线错误的是( )

| A.向NaAlO2溶液中滴入HCl至过量 |
| B.向澄清石灰水中通入CO2至过量 |
| C.向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量 |
| D.向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至沉淀消失 |
I(10分):A、B、C、D均为中学化学中常见的物质,它们之间转化关系如下图(部分产物已略去):
试回答:
(1)若D是具有氧化性的单质,则属于主族的金属A为___________(填元素符号)
(2)若D是金属,C溶液在储存时应加人少最D,其理由是(用必要的文字和离子方程式表示)_____ ___;
(3)若A、B、C为含同一种金属元素的无机化合物.在溶液中A和C反应生成B。请写出B转化为C的所有可能的离子力程式__________________________________.
化合物B经过一系列反应可以得到单质E,将一定质量的Mg和E的混合物投人500m1稀硫酸中,固体全部溶解并产生气体。待反应完全后.向所得溶液中加人NaOH溶液,生成沉淀的物质的是与加人溶液的体积关系如下图所示:
则固体混合物中Mg的质量为_____________;NaOH溶液的物质的量浓度为___________。
II(5分):某一离子反应体系有反应物和产物共以下六种:
MnO4—、H+、O2、H2O、H2O2、Mn2+
已知该反应中的H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是___________。
(2)该反应中.发生还原反应的过程是_____→_____。
(3)溶液随着酸性的增强氧化性不断增强,应选择__________(选填“稀硫酸”或“浓盐酸”)进行KMnO4溶液的酸化。
(4)如反应转移了0.6mo1电子,则产生的气体在标准状况下体积为__________。
某同学设计如图装置,研究非金属元素性质变化规律.
(1)已知硅酸(H2SiO3)是一种难溶于水的弱酸,呈白色。在化学反应中,一般地,强酸能制弱酸,如NaHCO3+HCl=NaCl+CO2↑+H2O,得出:HCl酸性强于H2CO3的酸性。现有硝酸溶液、碳酸钙、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:酸性:HNO3>H2CO3>H2SiO3。
A中装试剂________,B中装试剂____________,C中装试剂____________。C中实验现象为____________;写出C中发生反应的离子方程式_____________________________。
(2)已知高锰酸钾在常温下与浓盐酸反应产生氯气,利用如图装置证明氯气氧化性强于碘单质的氧化性。则A中装浓盐酸,B中装入高锰酸钾粉末,C中装试剂________,C中现象________,写出离子方程式__________________。该实验装置有明显不足,请指出改进方法:_______________________________________。
(3)如果C中装饱和的氢硫酸溶液,A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察到现象是C中产生淡黄色沉淀,写出化学方程式______________________________;证明氯的非金属性比硫的非金属性________(填“强”或“弱”或“无法判断”)。
试题篮
()