某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度与加入铁粉的物质的量之间的关系如图所示。则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为

| A.1∶1∶1 | B.1∶3∶1 |
| C.3∶3∶8 | D.1∶1∶4 |
氰[(CN)2]为无色可燃气体、剧毒、有苦杏仁味,是拟卤素的一种。拟卤素的性质与卤素相似。
(1)写出氰与苛性钠溶液反应的化学方程式: 。
(2)已知氰分子中键角为180°,分子具有对称性,(CN)2的结构式为 ,(CN)2的分子为(填“极性”或“非极性”) 分子。
(3)CN-中电子数为 。
类比是研究物质性质的常用方法之一,可预测许多物质的性质。但类比是相对的,不能违背客观事实。下列各种类比推测的说法中正确的是
①已知Fe与S能直接化合生成FeS,推测Cu与S可直接化合生成CuS
②已知CaCO3与稀硝酸反应生成CO2,推测CaSO3与稀硝酸反应生成SO2
③已知CO2分子是直线型结构,推测CS2分子也是直线型结构
④已知Fe与CuSO4溶液反应,推测Fe与AgNO3溶液也能反应
⑤已知NaOH是强电解质,其饱和溶液导电能力很强,Ca(OH)2也是强电解质,推测其饱和溶液导电能力也很强
| A.①③④ | B.①②⑤ | C.③④ | D.③④⑤ |
X、Y、Z、W四种化合物均由常见元素组成,其中X含有四种元素,Y、Z含有三种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有右图转化关系(部分反应物、产物及反应条件已略去)。请回答: 
(1)W的分子式是
(2)X与Y在溶液中反应的离子方程式是
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种无色气体。(该气体可以使带火星的木条复燃)
①装置Ⅰ中反应的化学方程式是 ,
装置Ⅱ中物质的化学式是 。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置Ⅴ中气体,该化合物的化学式是 ,所需仪器装置是
(从上图中选择必要装置,填写编号)。
向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X和另一种物质生成,该反应的化学方程式是
工业上常以软锰矿、闪锌矿(除主要成分为MnO2、ZnS外还含有少量的FeS、CuS、Al2O3等物质)为原料制取Zn和MnO2。
(1)已知将MnO2、ZnS浸在硫酸溶液中有少量黄色物质析出,写出并配平该化学反应方程式: 。
(2)在酸浸的过程中还会发生以下反应:
a.3MnO2 +2FeS +6H2SO4=3MnSO4 +Fe2(SO4)3+2S+ 6H2O
b.MnO2+CuS+4H2SO4=MnSO4+CuSO4+S+2H2O
c.Al2O3+3H2SO4=Al2(SO4)3+3H2O
将酸浸所得的酸性溶液按以下的工业流程进行操作处理得溶液(Ⅳ),电解溶液(Ⅳ)即得MnO2和Zn。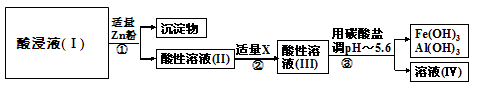
①操作①中加Zn粉后发生反应的离子方程式为:Zn+2H+=Zn2++H2↑、Zn+Cu2+=Zn2++Cu、 。
②操作②中加入适量X的作用是: 。
③操作③中所加碳酸盐的化学式是: 。
(3)为了从上述流程中产生的Fe(OH)3 、Al(OH)3沉淀混合物中回收Al(OH)3,某化学兴趣小组设计了如下两种方案图。
方案Ⅰ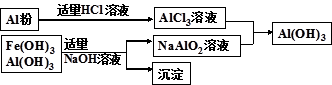
方案Ⅱ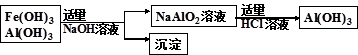
①方案Ⅰ中,AlCl3溶液和NaAlO2溶液反应生成Al(OH)3的离子方程式为: 。
②从消耗酸碱的用量角度考虑,方案 (填“Ⅰ”或“Ⅱ”)所消耗的酸碱少些。
A、B、C、D、E、X是中学常见的无机物,存在如下图转化关系(部分生成物和反应条件略去)。

(1)若A为常见的金属单质,焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式:_______________________。
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,则:
①组成单质A的元素在周期表中的位置为______________________。
②X可能为__________________(填代号)。
a.NaHCO3 b.Na2CO3 c.Na2SO3 d.Al(OH)3
(3)若A为淡黄色粉末,回答下列问题:
①A与H2O反应的氧化产物为_____________。
②若X为非金属单质,通常为黑色粉末,写出E的化学式______________。
③若X为一种造成温室效应的气体。则鉴别等浓度的D、E两种溶液,可选择的试剂为___________(填代号)。
a.盐酸 b.BaCl2溶液 c.NaOH溶液 d.Ca(OH)2溶液
(4)若A为氧化物,X是Fe,溶液D中加入KSCN溶液变红。
①A与H2O反应的化学反应方程式为____________________________。
②检验溶液D中还可能存在Fe2+的方法是____________________________(注明试剂、现象)。
有50mL某气体,可能含有CO2、O2、NH3中的一种或几种,将其通过浓H2SO4没有发现体积变化。通过足量Na2O2后,体积变为30mL,则该气体可能为( )
| A.CO2为20mL,NH3为30mL | B.NH3为40mL,O2为10mL |
| C.CO2为30mL,O2为20mL | D.CO2为40mL,O2为10mL |
一定条件下A、B、C有如图所示的转化关系,且△H=△H1+△H2 符合上述转化关系的A、C可能是

①Fe、FeCl3 ②C、CO2 ③AlCl3、NaAlO2 ④NaOH、NaHCO3 ⑤S、SO3 ⑥Na2CO3、CO2
A.只有②③④⑥ B.除①外 C.除⑤外 D.全部
大多数非金属元素有含氧酸根离子,某些金属元素也有含氧酸根离子:
MnO4-、MnO42-、Cr2O72-等。某无机盐M是一种优良的氧化剂,为确定其化学式,某小组设计并完成了如下实验:
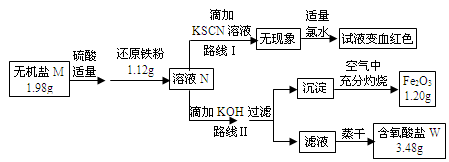
已知:
①无机盐M仅由钾离子和一种含氧酸根组成,其原子个数比为2:1:4
②如图中,将1.98g该无机盐溶于水,滴加适量稀硫酸后,再加入1.12g还原铁粉,整个过程无气体生成,恰好完全反应得混合溶液N.
③该小组同学将溶液N分为二等份,分别按路线Ⅰ、路线Ⅱ进行实验.
④在路线Ⅱ中,首先向溶液N中滴加适量KOH至元素X刚好沉淀完全,过滤后将沉淀在空气中充分灼烧得纯净的Fe2O3粉末1.20g;再将滤液在一定条件下蒸干,只得到3.48g纯净的不含结晶水的正盐W.
请按要求回答下列问题:
(1)由路线Ⅰ的现象可知,溶液N中含有的阳离子是 .
(2)由实验流程图可推得,含氧酸盐W的化学式是 ;由路线Ⅱ可知,1.98g无机盐M中所含钾元素的质量为 g.
(3)无机盐M与1.12g还原铁粉恰好完全反应生成溶液N的化学反应方程为 .
向含FeCl3、FeCl2、AlCl3、NaCl的溶液中,加入足量的Na2O2固体后,再加入过量的稀盐酸,溶液中离子数目不发生变化的是
| A.Na+ | B.Al3+ | C.Fe3+ | D.Fe2+ |
对溶液中的反应,如图像中m表示生成沉淀的物质的量,n表示参加反应的某一种反应物的物质的量,则下列叙述中错误的是:
| A.符合甲图像的两种反应物可以是AlCl3和NaOH |
| B.符合乙图像的两种反应物可以是Ca(OH)2和CO2 |
| C.符合丙图像的反应可以是在Ca(OH)2和KOH的混合溶液中通入CO2 |
| D.符合丙图像的反应可以是在NH4Al(SO4)2溶液中加入NaOH |
右图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列反应对应的曲线错误的是( )

| A.向NaAlO2溶液中滴入HCl至过量 |
| B.向澄清石灰水中通入CO2至过量 |
| C.向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量 |
| D.向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至沉淀消失 |
I(10分):A、B、C、D均为中学化学中常见的物质,它们之间转化关系如下图(部分产物已略去):
试回答:
(1)若D是具有氧化性的单质,则属于主族的金属A为___________(填元素符号)
(2)若D是金属,C溶液在储存时应加人少最D,其理由是(用必要的文字和离子方程式表示)_____ ___;
(3)若A、B、C为含同一种金属元素的无机化合物.在溶液中A和C反应生成B。请写出B转化为C的所有可能的离子力程式__________________________________.
化合物B经过一系列反应可以得到单质E,将一定质量的Mg和E的混合物投人500m1稀硫酸中,固体全部溶解并产生气体。待反应完全后.向所得溶液中加人NaOH溶液,生成沉淀的物质的是与加人溶液的体积关系如下图所示:
则固体混合物中Mg的质量为_____________;NaOH溶液的物质的量浓度为___________。
II(5分):某一离子反应体系有反应物和产物共以下六种:
MnO4—、H+、O2、H2O、H2O2、Mn2+
已知该反应中的H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是___________。
(2)该反应中.发生还原反应的过程是_____→_____。
(3)溶液随着酸性的增强氧化性不断增强,应选择__________(选填“稀硫酸”或“浓盐酸”)进行KMnO4溶液的酸化。
(4)如反应转移了0.6mo1电子,则产生的气体在标准状况下体积为__________。
某同学设计如图装置,研究非金属元素性质变化规律.
(1)已知硅酸(H2SiO3)是一种难溶于水的弱酸,呈白色。在化学反应中,一般地,强酸能制弱酸,如NaHCO3+HCl=NaCl+CO2↑+H2O,得出:HCl酸性强于H2CO3的酸性。现有硝酸溶液、碳酸钙、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:酸性:HNO3>H2CO3>H2SiO3。
A中装试剂________,B中装试剂____________,C中装试剂____________。C中实验现象为____________;写出C中发生反应的离子方程式_____________________________。
(2)已知高锰酸钾在常温下与浓盐酸反应产生氯气,利用如图装置证明氯气氧化性强于碘单质的氧化性。则A中装浓盐酸,B中装入高锰酸钾粉末,C中装试剂________,C中现象________,写出离子方程式__________________。该实验装置有明显不足,请指出改进方法:_______________________________________。
(3)如果C中装饱和的氢硫酸溶液,A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察到现象是C中产生淡黄色沉淀,写出化学方程式______________________________;证明氯的非金属性比硫的非金属性________(填“强”或“弱”或“无法判断”)。
试题篮
()