有关物质的转化关系如下图所示(部分物质和条件已略去)。A、C、E、G是中学化学中的常见单质,A为黑色粉末,G为黄绿色气体,E在G 中燃烧时发出苍白色火焰,F的焰色反应显黄色,B是常见的无色液体,K为红褐色沉淀。

请回答下列问题:
(1)G的化学式为 ,F的化学式为 。
(2)D、B、H混和生成J和I的离子方程式: 。
(3)常温下G与F的溶液反应的离子方程式:
(4)J转变为I的化学方程式:
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol/L的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示,则下列说法正确的是: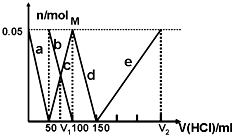
| A.原混合溶液中的CO2-3与AlO-2的物质的量之比为1:2 |
| B.V1:V2=1:5 |
| C.M点时生成的CO2为0.05mol |
| D.a曲线表示的离子方程式为:AlO-2+H++H2O=Al(OH)3↓ |
A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,C的溶液呈现黄色, A、B、C、D之间有如下图所示的转化关系:
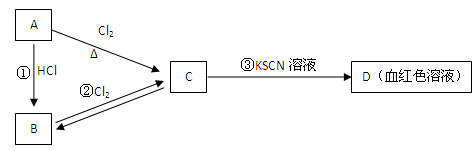
试回答下列问题:
(1)A是 ,C是 (填化学式)
(2)B的溶液与NaOH溶液混合的现象是
相应的化学方程为 、 。
(3)反应①的反应类型是 反应(选填“化合”、“分解”、“置换” “复分解”)。
(4)写出反应②的离子方程式 。
海水资源的利用具有广阔前景。海水中主要离子的含量如下:
| 成分 |
Cl- |
Na+ |
SO42- |
Mg2+ |
Ca2+ |
HCO3- |
Br- |
| 含量/(mg·L-1) |
18980 |
10560 |
2560 |
1272 |
400 |
142 |
64 |
(1)以食盐为原料进行生产并综合利用的某些过程如下图所示。

①除去粗盐中的Ca2+、Mg2+和SO 离子,加入沉淀剂a.Na2CO3 b.NaOH c.BaCl2,
离子,加入沉淀剂a.Na2CO3 b.NaOH c.BaCl2,
合理的一种顺序是(填序号) 。将滤液的pH调至酸性除去的离子是 。
②电解饱和食盐水的化学方程式是 ;
③侯德榜向饱和食盐水中通入NH3、CO2气体制NaHCO3晶体的化学方程式为 。
其依据是 。
④工业上可用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与Cl2制取有效成分为NaClO的消毒液,反应的化学方程式是 。(碳酸的酸性强于次氯酸)。
(2)利用海水可以提取溴和镁,提取过程如下:

① 从MgCl2溶液中得到MgCl2·6H2O晶体的主要实验操作是 、洗涤、烘干。从MgCl2·6H2O晶体中得到无水MgCl2的主要方法是
②用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_____________,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是_____________。
③依据上述流程,若将5 m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为 L(忽略Cl2溶解)。
FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:
I.实验需要90mL 0.10mol·L-1FeBr2溶液
(1)配制FeBr2溶液除烧杯、量筒、胶头滴管外还需的玻璃仪器是________。
(2)下列有关配制过程中说法错误的是________(填序号)。
a.用托盘天平称量质量为1.944g的FeBr2
b.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
II.探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
(3)请你完成下表,验证假设
| 实验步骤、预期现象 |
结论 |
| ①向溶液中加入四氯化碳,操作 现象 |
假设1正确 |
| ②向溶液中另入 现象 |
假设2正确 |
若假设1正确,从实验①分离出Br2的实验操作名称是
(4)若在50mL上述FeBr2溶液通入标准状况下112mL Cl2,反应的离子方程式为
根据下图海水综合利用的工业流程图,判断下列说法正确的是
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
| A.过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质 |
| B.在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2 |
| C.在过程④、⑥反应中每氧化0.2 mol Br- 需消耗2.24 L Cl2 |
| D.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 |
铵明矾 是分析化学常用基准试剂,其制备过程如下。下列分
是分析化学常用基准试剂,其制备过程如下。下列分
析不正确的是

A.过程I反应: |
| B.检验溶液B中阴离子的试剂仅需BaCl2溶液 |
| C.若省略过程II则铵明矾产率明显减小 |
| D.向铵明矾溶液中逐滴加入NaOH溶液先后观察到:刺激性气体逸出→白色沉淀 |
生成→白色沉淀消失
有一种混合气体,它可能由CO、CO2、SO2、HCl中的一种或多种气体组成。该气体依次通过下列物质的现象如下:通过一定量的澄清石灰水无白色沉淀析出;通过品红溶液,溶液红色褪去;通过炽热的CuO,固体变为红色;通过澄清石灰水,出现白色沉淀。该混合气体组成的各说法中,正确的是
| A.肯定不含有CO2 |
| B.只含有SO2和CO |
| C.含有SO2、CO和CO2,可能含HCl |
| D.含HCl、SO2和CO,可能含CO2 |
有50mL某气体,可能含有CO2、O2、NH3中的一种或几种,将其通过浓H2SO4没有发现体积变化。通过足量Na2O2后,体积变为30mL,则该气体可能为( )
| A.CO2为20mL,NH3为30mL | B.NH3为40mL,O2为10mL |
| C.CO2为30mL,O2为20mL | D.CO2为40mL,O2为10mL |
一定条件下A、B、C有如图所示的转化关系,且△H=△H1+△H2 符合上述转化关系的A、C可能是

①Fe、FeCl3 ②C、CO2 ③AlCl3、NaAlO2 ④NaOH、NaHCO3 ⑤S、SO3 ⑥Na2CO3、CO2
A.只有②③④⑥ B.除①外 C.除⑤外 D.全部
大多数非金属元素有含氧酸根离子,某些金属元素也有含氧酸根离子:
MnO4-、MnO42-、Cr2O72-等。某无机盐M是一种优良的氧化剂,为确定其化学式,某小组设计并完成了如下实验:
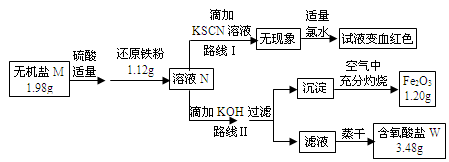
已知:
①无机盐M仅由钾离子和一种含氧酸根组成,其原子个数比为2:1:4
②如图中,将1.98g该无机盐溶于水,滴加适量稀硫酸后,再加入1.12g还原铁粉,整个过程无气体生成,恰好完全反应得混合溶液N.
③该小组同学将溶液N分为二等份,分别按路线Ⅰ、路线Ⅱ进行实验.
④在路线Ⅱ中,首先向溶液N中滴加适量KOH至元素X刚好沉淀完全,过滤后将沉淀在空气中充分灼烧得纯净的Fe2O3粉末1.20g;再将滤液在一定条件下蒸干,只得到3.48g纯净的不含结晶水的正盐W.
请按要求回答下列问题:
(1)由路线Ⅰ的现象可知,溶液N中含有的阳离子是 .
(2)由实验流程图可推得,含氧酸盐W的化学式是 ;由路线Ⅱ可知,1.98g无机盐M中所含钾元素的质量为 g.
(3)无机盐M与1.12g还原铁粉恰好完全反应生成溶液N的化学反应方程为 .
向含FeCl3、FeCl2、AlCl3、NaCl的溶液中,加入足量的Na2O2固体后,再加入过量的稀盐酸,溶液中离子数目不发生变化的是
| A.Na+ | B.Al3+ | C.Fe3+ | D.Fe2+ |
对溶液中的反应,如图像中m表示生成沉淀的物质的量,n表示参加反应的某一种反应物的物质的量,则下列叙述中错误的是:
| A.符合甲图像的两种反应物可以是AlCl3和NaOH |
| B.符合乙图像的两种反应物可以是Ca(OH)2和CO2 |
| C.符合丙图像的反应可以是在Ca(OH)2和KOH的混合溶液中通入CO2 |
| D.符合丙图像的反应可以是在NH4Al(SO4)2溶液中加入NaOH |
试题篮
()