足量铜溶于一定量浓硝酸,产生NO2、N2O4、NO的混合气体,这些气体若与2.24LO2(标准状况)混合后通入水中,气体被水完全吸收。若向原所得溶液中加入l0 mol·L-1H2SO4溶液100 mL,则继续溶解的Cu的质量为( )
| A.0 | B.32g | C.38.4g | D.48g |
Ⅰ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色。
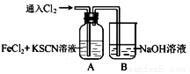
(1)B中反应的离子方程式是 ;
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验。取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在 ;
(3)资料显示:SCN -的电子式为 。甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究。
。甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究。
①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN﹣中被氧化的元素是 ;
②甲同学通过实验证明了SCN﹣中氮元素转化为NO3﹣,已知SCN﹣中碳元素没有被氧化,若SCN﹣与Cl2反应生成1mol CO2,则转移电子的物质的量是 mol;
Ⅱ.8.12天津港特大爆炸事故现场有700吨左右氰化钠,氰化钠剧毒。有少量因爆炸冲击发生泄漏。这些泄露的氰化钠可通过喷洒氧化剂双氧水的方式来处理,以减轻污染。
请写出NaCN的电子式___________,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3﹣,同时放出NH3,该反应的离子方程式为 。
已知化合物A、B、C、D、E、F、G和单质甲、乙所含元素均为短周期元素,A的浓溶液与甲能发生如下图所示的反应,甲是常见的黑色固体单质,可为生产生活提供热能,乙是常见的无色气体单质,B是无色有刺激性气味的气体,是主要的大气污染物之一,常温下,C是一种无色液体.
请回答下列问题
(1)C的化学式_________;
(2)D的电子式_________;
(3)写出C+E→F+乙的离子方程式_________;
(4)写出B+C+乙→A的化学方程式并用单线桥表示电子转移的方向和数目_________;
类比是研究物质性质的常用方法之一,可预测许多物质的性质。但类比是相对的,不能违背客观事实。下列各种类比推测的说法中正确的是
①已知Fe与S能直接化合生成FeS,推测Cu与S可直接化合生成CuS
②已知CaCO3与稀硝酸反应生成CO2,推测CaSO3与稀硝酸反应生成SO2
③已知CO2分子是直线型结构,推测CS2分子也是直线型结构
④已知Fe与CuSO4溶液反应,推测Fe与AgNO3溶液也能反应
⑤已知NaOH是强电解质,其饱和溶液导电能力很强,Ca(OH)2也是强电解质,推测其饱和溶液导电能力也很强
| A.①③④ | B.①②⑤ | C.③④ | D.③④⑤ |
下列各表述与示意图一致的是( )

| A.图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积关系图。则三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=2:1:2,其中使用的NaOH的浓度为2 mol•L-1 |
| B.图②中曲线表示某反应过程的能量变化,当物质A(g)与B(g)反应生成物质C(g)是,△H>0,若使用正催化剂,E值会减小 |
| C.图③可用来表示向盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)之间的关系图 |
| D.图④表示向一定质量的明矾溶液中滴加Ba(OH)2溶液时,产生沉淀的质量(m)与加入Ba(OH)2溶液体积(V)之间的关系图 |
向含有Fe2+、Fe3+、Mg2+、NH4+的水溶液中,加入足量的Na2O2固体,充分反应后再加入过量的稀盐酸,上述离子数目没有变化的是
| A.Fe2+ | B.NH4+ | C.Fe3+ | D.Mg2+ |
(Ⅰ)浓硝酸与浓盐酸混合过程中会产生少量的黄绿色气体单质X、化合物M和无色液体,化合物M中所有原子均达到8电子的稳定结构。2mol M加热分解生成1mol氧化产物X和2mol无色气体Y,Y遇到空气呈现红棕色。
(1)镁与气体X反应产物的电子式 。
(2)浓硝酸与浓盐酸反应的化学方程式为 。
(3)化合物M水解生成两种酸,为非氧化还原反应,该反应的化学方程式为 。
(Ⅱ)石油铁储罐久置未清洗易引发火灾,经分析研究,事故是由罐体内壁附着的氧化物甲与溶于石油中的气态氢化物乙按1︰3反应生成的物质丙自燃引起的。某研究小组将一定量的丙粉末投入足量的浓盐酸中发生反应,得到4.8g淡黄色固体和气体乙,乙在标准状况下的密度为1.52g·L-1。过滤后向滤液(假设乙全部逸出)中加入足量的NaOH溶液,先出现白色沉淀,最终转变为红褐色沉淀,过滤、洗涤、灼烧后的固体质量为24g。已知气体乙可溶于水。请回答下列问题:
(4)甲的化学式为 。
(5)丙在盐酸中反应的化学方程式为 。
(6)丙与盐酸反应后的滤液暴露在空气中一段时间颜色加深,其原因是(用离子方程式表示) 。
(7)为消除石油铁储罐的火灾隐患,下列措施可行的是(填编号) 。
| A.石油入罐前脱硫 | B.定期用酸清洗罐体 |
| C.罐体内壁涂刷油漆 | D.罐体中充入氮气 |
用右图所示装置进行相应的实验,能达到实验目的或得出相应结论的是
| |
① |
② |
③ |
实验结论或目的 |
 |
| A |
浓盐酸 |
KMnO4 |
石蕊试液 |
氯气的水溶液有酸性、漂白性 |
|
| B |
稀硫酸 |
Na2S |
AgNO3与AgCl的浊液 |
Ksp(AgCl)>Ksp(Ag2S) |
|
| C |
硝酸 |
Na2CO3溶液 |
Na2SiO3溶液 |
比较硝酸、碳酸、硅酸酸性强弱 |
|
| D |
溴水 |
FeBr3、苯 |
AgNO3溶液 |
苯和溴水能发生取代反应 |
中学常见物质A、B、C、D、E、X,存在下图转化关系(部分生成物和反应条件略去)。下列推断不正确的是
A.若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
B.若D是一种强碱,则A、B、C均可与X反应生成D
C.若D为NaCl,且A可与C反应生成B,则E可能是CO2
D.若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B
有50mL某气体,可能含有CO2、O2、NH3中的一种或几种,将其通过浓H2SO4没有发现体积变化。通过足量Na2O2后,体积变为30mL,则该气体可能为( )
| A.CO2为20mL,NH3为30mL | B.NH3为40mL,O2为10mL |
| C.CO2为30mL,O2为20mL | D.CO2为40mL,O2为10mL |
一定条件下A、B、C有如图所示的转化关系,且△H=△H1+△H2 符合上述转化关系的A、C可能是

①Fe、FeCl3 ②C、CO2 ③AlCl3、NaAlO2 ④NaOH、NaHCO3 ⑤S、SO3 ⑥Na2CO3、CO2
A.只有②③④⑥ B.除①外 C.除⑤外 D.全部
大多数非金属元素有含氧酸根离子,某些金属元素也有含氧酸根离子:
MnO4-、MnO42-、Cr2O72-等。某无机盐M是一种优良的氧化剂,为确定其化学式,某小组设计并完成了如下实验:
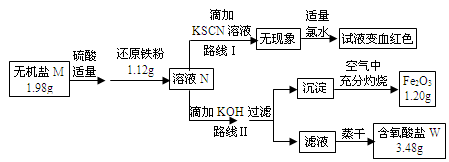
已知:
①无机盐M仅由钾离子和一种含氧酸根组成,其原子个数比为2:1:4
②如图中,将1.98g该无机盐溶于水,滴加适量稀硫酸后,再加入1.12g还原铁粉,整个过程无气体生成,恰好完全反应得混合溶液N.
③该小组同学将溶液N分为二等份,分别按路线Ⅰ、路线Ⅱ进行实验.
④在路线Ⅱ中,首先向溶液N中滴加适量KOH至元素X刚好沉淀完全,过滤后将沉淀在空气中充分灼烧得纯净的Fe2O3粉末1.20g;再将滤液在一定条件下蒸干,只得到3.48g纯净的不含结晶水的正盐W.
请按要求回答下列问题:
(1)由路线Ⅰ的现象可知,溶液N中含有的阳离子是 .
(2)由实验流程图可推得,含氧酸盐W的化学式是 ;由路线Ⅱ可知,1.98g无机盐M中所含钾元素的质量为 g.
(3)无机盐M与1.12g还原铁粉恰好完全反应生成溶液N的化学反应方程为 .
向含FeCl3、FeCl2、AlCl3、NaCl的溶液中,加入足量的Na2O2固体后,再加入过量的稀盐酸,溶液中离子数目不发生变化的是
| A.Na+ | B.Al3+ | C.Fe3+ | D.Fe2+ |
对溶液中的反应,如图像中m表示生成沉淀的物质的量,n表示参加反应的某一种反应物的物质的量,则下列叙述中错误的是:
| A.符合甲图像的两种反应物可以是AlCl3和NaOH |
| B.符合乙图像的两种反应物可以是Ca(OH)2和CO2 |
| C.符合丙图像的反应可以是在Ca(OH)2和KOH的混合溶液中通入CO2 |
| D.符合丙图像的反应可以是在NH4Al(SO4)2溶液中加入NaOH |
试题篮
()