向含FeCl3、FeCl2、AlCl3、NaCl的溶液中,加入足量的Na2O2固体后,再加入过量的稀盐酸,溶液中离子数目不发生变化的是
| A.Na+ | B.Al3+ | C.Fe3+ | D.Fe2+ |
富铁铝土矿(主要含有A12O3、Fe2O3、FeO和SiO2)可制备新型净水剂液体聚合硫酸铝铁[AlaFeb(OH)m(SO4)n]。研究发现,当a=b时净水效果最好。工艺流程如下(部分操作和产物略):
(1)A12O3与H2SO4发生反应的离子方程式是____________。
(2)测得滤液中 。加入FeSO4·7H2O和H2O2的作用是(结合化学用语说明)____________。
。加入FeSO4·7H2O和H2O2的作用是(结合化学用语说明)____________。
(3)将溶液A电解得到液体聚合硫酸铝铁。装置如图所示(阴离子交换膜只允许阴离子通过,电极为惰性电极)
① 阴极室的电极反应式是__________。
② 电解过程阳极室溶液pH的变化是____________(填“增大”、“减小”或“不变”)。
③ 简述在反应室中生成液体聚合硫酸铝铁的原理____________。
已知有以下物质相互转化

试回答:
(1)写出B的化学式 C的化学式 D的化学式 。
(2)写出由E转变成F的化学方程式 。
(3)把KSCN加到G溶液中的现象是 ;向G溶液加入A的有关离子反应方程式 _______。
(4) 焰色反应是 (填物理或化学)变化,经过焰色反应试验后的铂丝可选择下面 (填字母)试剂清洗。 A 硫酸 B 盐酸 C 硝酸
A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,C的溶液呈现黄色, A、B、C、D之间有如下图所示的转化关系:
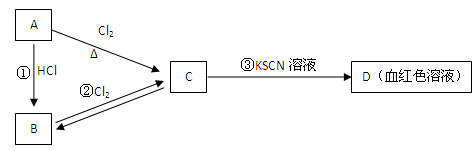
试回答下列问题:
(1)A是 ,C是 (填化学式)
(2)B的溶液与NaOH溶液混合的现象是
相应的化学方程为 、 。
(3)反应①的反应类型是 反应(选填“化合”、“分解”、“置换” “复分解”)。
(4)写出反应②的离子方程式 。
已知A、B为单质,C为化合物。则下列说法正确的是( )
A+B C
C C溶液
C溶液 A+B
A+B
①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液遇Na2CO3放出CO2气体,则A可能是H2
③若C溶液中滴加KSCN溶液显血红色,则B可能为Fe
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A.①② B.③④ C.①③ D.②④
铵明矾 是分析化学常用基准试剂,其制备过程如下。下列分
是分析化学常用基准试剂,其制备过程如下。下列分
析不正确的是

A.过程I反应: |
| B.检验溶液B中阴离子的试剂仅需BaCl2溶液 |
| C.若省略过程II则铵明矾产率明显减小 |
| D.向铵明矾溶液中逐滴加入NaOH溶液先后观察到:刺激性气体逸出→白色沉淀 |
生成→白色沉淀消失
(Ⅰ)A、B、C、D、E、F为中学化学中的常见物质,且物质A由l~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题。

(1)已知常温下A为有色气体。若F是一种金属单质,写出B和适量F反应生成C与气体E的离子方程式_______________________;
(2)若A为双原子分子,C为直线型分子,E具有漂白性,物质F焰色反应呈黄色.则F的化学式为_____________________。
(3)若A为淡黄色固体,则A与水反应的化学方程式为_________________。
①若物质B和D的式量相等,D为淡黄色固体物质,C的大量排放往往会造成严重的环境问题即_______________。C与F反应的化学方程式为________________;
②若物质A和D的式量相等,D为白色絮状沉淀,写出C与F反应的离子方程式_________________________。
(Ⅱ)亚磷酸(H3PO3)是二元弱酸,与足量NaOH溶液反应,生成Na2HPO3。
(1)根据H3PO3的性质可推测Na2HPO3稀溶液的pH______7(填“>”“<”或“=”)。常温下,向10mL0.01 mol·L-1H3PO3溶液中滴加10mL0.02 mol·L-1NaOH溶液后,溶液中各种离子浓度由大到小的顺序是_________ ;
(2)亚磷酸具有强还原性,可将Cu2+还原为金属单质,亚磷酸与硫酸铜溶液反应的方程式为______.
某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
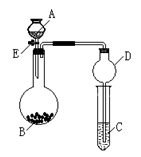
(1)若A为水,B为过氧化钠,C中盛有稀硫酸和FeCl2混合溶液,旋开 活塞E后,C中溶液颜色变化为 ,烧瓶中发生反应的化学方程式为 。
(2)若A为盐酸、B为大理石(主要成分为CaCO3粉末)、C中盛有水玻璃,则小试管中的现象是 ,固体的主要成分为(写化学式)_________________。
(3)利用上述装置可以验证SO2的性质, 若A为浓硫酸,B为亚硫酸钠粉末,那么C中盛有 溶液时可验证其具有漂白性;而C中盛有 溶液时可验证其具有还原性(各填一种物质名称)。
X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X—的半径,Y2是空气主要成分之一。请回答:
(1)Q元素在周期表中的位置_______________________;
(2)这五种元素原子半径从大到小的顺序为_______________________(填元素符号)
(3)元素的非金属性Z_________Q(填“>”或“<”),下列各项中,不能说明这一结论的事实有___________(填序号)
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q的单质的状态
D.Z和Q在周期表中的位置
(4)Q的氢化物与它的低价氧化物反应的化学方程式为_____________________
(5)X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,写出A的电子式____________;实验室制备气体A的化学方程式 B的水溶液不呈中性的原因___________________(用离子方程式表示)
(6)若使A按下列途径完全转化为F:

①F的化学式为_____________;
②C→F过程中氧化剂与还原剂的物质的量之比为_____________。
向18.4g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成NO2、NO混合气体,再向所得溶液中加入足量的NaOH溶液,生成30.3g沉淀.另取等质量的合金,使其与一定量的氯气恰好完全反应,则氯气的体积在标准状况下为( )
| A.7.84L | B.6.72L | C.4.48L | D.无法计算 |
海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:

(1)将NaCl溶液进行电解,在电解槽的阴极区获得的产品有________________(填化学式)。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是_____________________。
(3)某化学小组的同学为了了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59 ℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下实验装置:
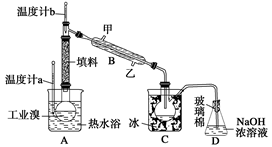
①图中仪器B的名称是 ,冷却水的出口为 (填“甲”或“乙”)。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是 。
③C中液体的颜色为 。
④D装置的作用是 。
类比是研究物质性质的常用方法之一,可预测许多物质的性质。但类比是相对的,不能违背客观事实。下列各种类比推测的说法中正确的是
①已知Fe与S能直接化合生成FeS,推测Cu与S可直接化合生成CuS
②已知CaCO3与稀硝酸反应生成CO2,推测CaSO3与稀硝酸反应生成SO2
③已知CO2分子是直线型结构,推测CS2分子也是直线型结构
④已知Fe与CuSO4溶液反应,推测Fe与AgNO3溶液也能反应
⑤已知NaOH是强电解质,其饱和溶液导电能力很强,Ca(OH)2也是强电解质,推测其饱和溶液导电能力也很强
| A.①③④ | B.①②⑤ | C.③④ | D.③④⑤ |
Ⅰ.实验室常见的几种气体发生装置如图A、B、C所示:

(1)实验室可以用B或C装置制取氨气,如果用B装置制取氨气其化学反应方程式为______________。
(2)气体的性质是选择气体收集方法的主要依据。下列性质与收集方法无关的是________(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
(3)若用A装置与D装置相连制取并收集X气体,则X可以是下列气体中的__________。
①CO2 ②NO ③Cl2 ④H2 ⑤HCl
其中在D装置中连接小烧杯的目的是____________________。
Ⅱ.某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验。
(1)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3,钴的化合价为____________,试写出X的化学式_______________________。
(2)氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL cl mol·L-1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。

氨的测定装置(已省略加热和夹持装置)
①装置中安全管的作用原理是_______________________。
②样品中氨的质量分数表达式为_____________________。
用右图所示装置进行相应的实验,能达到实验目的或得出相应结论的是
| |
① |
② |
③ |
实验结论或目的 |
 |
| A |
浓盐酸 |
KMnO4 |
石蕊试液 |
氯气的水溶液有酸性、漂白性 |
|
| B |
稀硫酸 |
Na2S |
AgNO3与AgCl的浊液 |
Ksp(AgCl)>Ksp(Ag2S) |
|
| C |
硝酸 |
Na2CO3溶液 |
Na2SiO3溶液 |
比较硝酸、碳酸、硅酸酸性强弱 |
|
| D |
溴水 |
FeBr3、苯 |
AgNO3溶液 |
苯和溴水能发生取代反应 |
试题篮
()