将适量的SO2通入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,继续滴入BaCl2溶液,产生白色沉淀。在上述一系列变化过程中,最终被还原的元素是
| A.S | B.Fe | C.Cl | D.N |
硝酸与金属反应时,还原产物可能是NO2、NO、N2O、N2或NH 中的一种或几种。现有一定量的Al粉和Fe粉的混合物与100mL稀硝酸充分反应,反应过程中无任何气体放出。在反应结束后的溶液中逐滴加入4mol/L的NaOH溶液,加入NaOH溶液的体积与产生沉淀的物质的量的关系如图,则下列说法中不正确的是
中的一种或几种。现有一定量的Al粉和Fe粉的混合物与100mL稀硝酸充分反应,反应过程中无任何气体放出。在反应结束后的溶液中逐滴加入4mol/L的NaOH溶液,加入NaOH溶液的体积与产生沉淀的物质的量的关系如图,则下列说法中不正确的是
| A.与HNO3反应后,Fe元素的化合价为+3 |
B.D→E段反应的离子方程式为:NH +OH-=NH3·H2O +OH-=NH3·H2O |
| C.纵坐标A点数值为0.008 |
| D.纵坐标B点数值为0.012 |
科学家用NaNO3和Na2O在一定条件下化合制得由钠离子和阴离子B构成的晶体NaxNO4,测得阴离子B中各原子的最外层电子都达到了8电子稳定结构。下列说法错误的是
| A.x=3 | B.N的化合价为+3 |
| C.阴离子B的电子式可能为 | D.此反应是非氧化还原反应 |
氮化硅是一种新合成的结构材料,它是一种超硬、耐磨、耐高温的物质。下列各组物质熔化时,所克服的粒子间的作用力与氮化硅所克服的粒子间的作用力都相同的是
| A.石膏和金刚石 | B.晶体硅和水晶 |
| C.冰和干冰 | D.铝和蒽 |
下列各组物质相互混合反应,既有气体生成,最终又有沉淀生成的是:
①金属钠投入到FeCl3溶液 ②过量NaOH溶液和明矾溶液
③少量电石投入过量NaHCO3溶液 ④Na2O2投入FeCl2溶液
| A.① | B.③ | C.②③ | D.①③④ |
对于以下反应,改变反应物用量,能用同一个离子方程式表示的是
| A.Ca(HCO3)2溶液与石灰水反应 | B.Na2SO3溶液与稀盐酸反应 |
| C.Cl2与FeBr2溶液反应 | D.NaHSO4溶液与Ba(OH)2溶液反应 |
下列叙述正确的是
| A.硝酸溶液、硫酸溶液均能将木炭氧化成二氧化碳 |
| B.若金属能与水发生反应,则一定有氢气生成,不一定有碱生成 |
| C.Na、S、C分别在氧气中点燃均可能得到两种不同的氧化物 |
| D.结合质子的能力HCO3—比CO32—强 |
向含有0.2 mol氢氧化钠和0.1 mol氢氧化钙的溶液中,持续稳定地通入二氧化碳气体,通入气体为6.72 L(标准状况)时,立即停止,则这一过程中,溶液中离子数目与通入二氧化碳气体体积的关系正确的是(不考虑气体的溶解)
现有H2SO4、BaCl2、K2CO3、FeSO4和氯水五种溶液,有如图所示的相互关系,图中每条连线两端的物质可以发生化学反应。下列推断不合理的是
| A.X一定为H2SO4 | B.Y一定为K2CO3 |
| C.Z可能是氯水 | D.M可能为FeSO4 |
下列推断合理的是

A.明矾[KAl(SO4)2·12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 |
B.金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 |
C.浓H2SO4有强氧化性,不能与Cu发生剧烈反应 |
D.铁和氯气反应生成FeCl3,铁和I2反应生成FeI3 |
以下物质间的每步转化,存在不能通过一步反应实现的是

| A.SO2→SO3→H2SO4→MgSO4 | B.Fe→FeCl2→Fe(OH)2→Fe(OH)3 |
C.Al→Al2O3→Al(OH)3→NaAlO2 | D.N2→NO→NO2→HNO3 |
以下每个选项中的两组物质都能反应,且放出同一种气体产物的是
| A.铜与稀硫酸,铜与浓硫酸 | B.铁与稀硫酸,铁与浓硫酸 |
| C.硫化钠与稀硫酸,亚硫酸钠与稀硫酸 | D.硫化钠与稀硫酸,硫化钠与稀盐酸 |
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。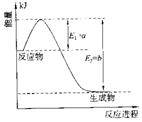
 (1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题: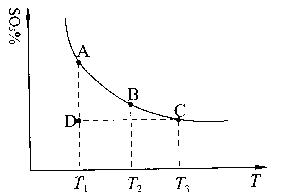
 ①2SO2(g)+O2(g) 2SO3(g)的△H 0(填“>”或“<”);若在恒温、
①2SO2(g)+O2(g) 2SO3(g)的△H 0(填“>”或“<”);若在恒温、
恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或
“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2;若反应进行到状
态D时,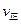
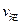 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
①右图是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式: 。(△H的数值用含字母a、b的代数式表示)②氨气溶于水得到氨水。在25°C下,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH+4) c(Cl-)(填“>”、“<”或“=”);用含a和b的代数式表示出氨水的电离平衡常数表达式 。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25°C下,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1硝酸银溶液,有白色沉淀生成。从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(已知25°C时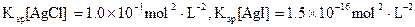 )
)
氢化锂(LiH)、氘化锂(LiD)、氚化锂、(LiT)在一定条件下都可产生极高的能量,被广泛应用在火箭推进剂和核反应中。下列有关说法中,正确的是 ( )
A.LiH、LiD、LiT是同一种物质
B.LiH、LiD、LiT中氢元素的合化价均为+1价
C.H、D、T之间互称为同位素
D. LiH、LiD、LiT在反应中常做氧化剂
试题篮
()