如图装置中,容器甲内充入0.1mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的9/10,随着CO2的继续通入,活塞又逐渐向右移动。(不考虑活塞的摩擦)

已知:2Na2O2+2CO2→2Na2CO3+O2
(1)已知当活塞移至C处时,干燥管中物质的质量增加了2.24g。
①此时,通入标准状况下的CO2气体为 L。
②容器甲中NO2转化为N2O4的转化率是 。
③活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处.则a值必 0.01(填大于、小于、等于),其理由是 。
(2)若改变干燥管中Na2O2的量,要通过调节甲容器的温度及通入的量CO2,使活塞发生从D到C,又从C到D的移动,则Na2O2的质量最小值应大于 g。
有一澄清透明的溶液,可能大量存在有NH4+、Fe3+、H+、Mg2+、A13+、I-、CO32-等离子。现分别取溶液进行下列实验:
(1)加人淀粉溶液,未见蓝色。
(2)加人少量AgNO3溶液有黄色沉淀和气体生成。
(3)逐滴加人1mol·L-1NaOH溶液,随着NaOH溶液的滴人,产生沉淀的量如图所示。
试确定:溶液中一定不存在的离子有________,其中阴离子物质的量为_________,加人少量AgNO3溶液的离子反应方程式为________________。
某结晶水合物A含有两种阳离子和一种阴离子。将溶有90.60gA的水溶液分成两等份,向第一份逐滴加入NaOH溶液,溶液先出现白色沉淀后完全溶解,此过程中产生2.24 L(标准状况)刺激性气味的气体。向第二份加入过量的Ba(OH)2溶液,过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.60 g。
请回答以下问题:
(1)A的摩尔质量为 。
(2)试通过计算确定该结晶水合物的化学式为 。
(3)若第二份加入75.00 mL2.00 mol·L-1的Ba(OH)2溶液,则得到的沉淀质量为 。
某研究小组以CaCl2和H2为原料,试图制备 +1价Ca的化合物,结果发现产物中只有两种化合物(甲和乙)。元素组成分析表明化合物甲中钙、氯元素的质量分数分别为52.36%、46.33%;化合物乙的水溶液显酸性。请回答下列问题:
(1)生成甲的化学反应方程式为
(2)甲与水反应可得H2,其化学方程式是 。
(3)在加热条件下,乙的水溶液(浓)与MnO2反应的离子方程式是 ;乙的水溶液与Fe反应所得的溶液不稳定,保存该溶液的措施是 。
(4)请写出一个你认为可能得到CaCl的化学方程式(以CaCl2为原料) 。
向炭粉、Cu和Fe2O3组成的混合粉末中加入一定量的稀硫酸,充分反应后过滤,得到溶液A,将沉淀物洗涤、干燥,得到固体B。
(1)碳的原子结构示意图为 ,氧元素在周期中的位置是
(2)加入稀硫酸后,发生反应的离子方程式 ,溶液A中一定存在的金属阳离子是 。
(3)关于固体B的成分,下列选项中可能的有 。
A.炭粉
B.炭粉和Cu
C.炭粉和Fe2O3
D.Cu和Fe2O3
E.炭粉、Cu和Fe2O3
以食盐为原料进行生产并综合利用的某些过程如下图所示。
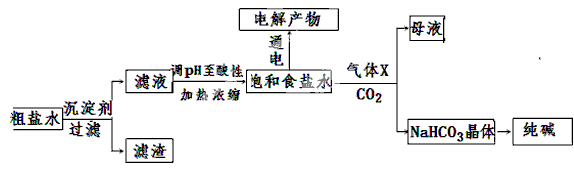
(1)除去粗盐中的Ca2+、Mg2+和SO42-离子,加入下列沉淀剂的顺序是(填字母) 。
a.Na2CO3 b.NaOH c.BaCl2
(2)将滤液的pH调至酸性除去的离子是 。
(3)电解饱和食盐水可得到H2和另外两种产物,这两种物质相互反应的离子方程式为 ,欲从饱和食盐水中获得食盐晶体,可采用的实验方法是 。
(4)气体X可增大饱和食盐水吸收CO2的量,有利于NaHCO3晶体的生成和析出,X的化学式是 。
(5)下列有关NaHCO3和纯碱的说法正确的是 (填字母)
| A.NaHCO3属于盐类,纯碱属于碱 |
| B.分别往同浓度的NaHCO3溶液和纯碱溶液中滴加稀盐酸,产生气泡的速率相同 |
| C.常温下在水中的溶解度,NaHCO3大于纯碱 |
| D.除去NaHCO3溶液中的纯碱,应往溶液中通入足量的CO2 |
氢气还原氧化铜反应不完全时,得到的是Cu、Cu2O、CuO的固体混合物。某化学兴趣小组为了探究某次氢气还原CuO实验最终所得的产物的组成,进行了如下实验:
①取一定质量的均匀的上述固体混合物A,将其分成两等份。
②取其中一份用足量的氢气还原,测得反应后固体的质量减小了3.20g
③另一份加入500mL的稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体2.24L。
请回答以下问题:
(1)A中,所含氧元素的物质的量为_________。
(2)A中,n(Cu)+n(Cu2O)=_______________。
(3)所用稀硝酸的物质的量浓度为_______________。
目前,回收溴单质的方法主要有水蒸气蒸馏法和萃取法等。某兴趣小组通过查阅相关资料拟采用如下方案从富马酸废液(含溴0.27%)中回收易挥发的Br2:

(1)操作X所需要的主要玻璃仪器为 ;反萃取时加入20%的NaOH溶液,其离子方程式为 。
(2)反萃取所得水相酸化时,需缓慢加入浓硫酸,并采用冰水浴冷却的原因是: 。
(3)溴的传统生产流程为先采用氯气氧化,再用空气水蒸气将Br2吹出。与传统工艺相比,萃取法的优点是 。
(4)已知在酸性条件下溴酸盐可发生如下离子反应:
Ⅰ.2BrO+10Cl-+12H+===5Cl2↑+Br2+6H2O;Ⅱ.6BrO+5Cl-+6H+===5ClO+3Br2+3H2O,现将120 mL 0.4 mol·L-1KBrO3溶液和100 mL 0.6 mol·L-1KCl溶液在稀H2SO4中混合,充分反应后,产物KClO3和Cl2的物质的量之比为________。
H、C、N、O、Fe、Si、I是中学化学中常见的元素,请根据题意回答与这些元素有关的问题:
(1)根据元素周期律,碳的非金属性强于硅,请用一个化学反应方程式表示___________________。
(2)若FeSO4和O2的系数比为2:1,试配平下列方程式:__FeSO4+__K2O2→__K2FeO4+__K2O+__K2SO4+__O2↑
(3)各种氮氧化物(NO、NO2)是主要的大气污染物之一,治理氮氧化物(NOX)废气的方法之一是用NaOH溶液进行吸收,其反应原理可表示如下:NO2+NO+2NaOH=2NaNO2+H2O 2NO2+2NaOH=NaNO2+NaNO3+H2O
现有一NO与NO2的混合气体,将其通入50mL 2mol/L的NaOH溶液中,恰好完全吸收,测得溶液中含有NO3― 0.02mol。
①所得溶液中NaNO2的物质的量为 mol;
②混合气体中V(NO):V(NO2)= 。
(4)向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-、Fe2+、Fe3+等粒子物质的量随n(Cl2)/n(FeI2)的变化可用下图简单表示

①当n(Cl2)∶n(FeI2)=6.5时,溶液中n(Cl-)∶n(IO3-)= 。
②当n(Cl2)∶n(FeI2)=1.2时,离子方程式可表示为 。
从明矾[KAl(SO4)2·12H2O]制备Al、K2SO4和H2SO4的流程如下:

已知:明矾焙烧的化学方程式为:4[KAl(SO4)2·12H2O] + 3S=2K2SO4 + 2Al2O3 + 9SO2↑+ 48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化产物与还原产物的物质的量之比为: 。
(2)步骤②中,为提高浸出率,可采取的措施有_____________。
| A.粉碎固体混合物 | B.降低温度 | C.不断搅拌 | D.缩短浸泡时间 |
(3)明矾焙烧完全后,从步骤②的滤液中得到K2SO4晶体的方法是 。
(4)步骤③电解的化学方程式是 ,电解池的电极是用碳素材料做成,电解过程中,阳极材料需要定期更换,原因是: 。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,则该电池的正极电极反应式是 。
(6)焙烧a吨明矾(摩尔质量为b g/mol),若SO2的转化率为96%,可生产质量分数为98%的H2SO4质量为 吨(列出计算表达式)。
硫铁矿【主要成分是二硫化亚铁(FeS2)】是一种重要的化工原料,常用来制备铁、硫酸和氯化铁,其工业流程示意图如图.(资料:Fe+2FeCl3=3FeCl2)

(1)Ⅱ中反应的化学方程式是 .
Ⅲ中反应的化学方程式是 .
(2)结合上述流程,硫铁矿中硫元素的化合价 ,如图出现的含硫元素的物质中,属于氧化物的有 (填化学式).
(3)若向溶液乙和丙的稀溶液中分别加入足量的甲,观察到的现象不同点是
I:钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。

请回答下列问题:
(1)Fe位于元素周期表中第________周期,第________族。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
Ⅱ:A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。

试回答:
(1)若X是强氧化性单质,则A不可能是________________。
a.S b.N2 c.Na d.Mg e.Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为____________;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示)____________。
(3)A还可以是氨气,氨气分子的空间构型是 。
常见金属单质A可发生如图所示转化(部分反应物、产物和反应条件已略去)。F是一种温室气体;气体G的水溶液显弱碱性;H是一种具有磁性的黑色氧化物;B、C、D、E四种化合物中含有一种相同的元素。
请回答下列问题:
(1)写出F的电子式________________,实验室制取G的化学方程式为______________________。
(2)写出反应I的离子方程式_______________。该反应中的氧化剂是______________________。
(3)反应I、Ⅱ均有清洁能源H2产生。已知H2的燃烧热为286 kJ·mol-1,18 g水蒸气变成液态水放出44 kJ的热量。其它相关数据如下表:
则表中x为______________
(4)写出A与H反应的化学方程式________________________________,实验测得该反应的焓变(△H)和活化能(Ea)。下列能量关系图合理的是_________________(填写序号)。
(5)资料显示H可用于除去地下水中的TcO4-(99Tc具有放射性)。在酸性条件下,H将TcO4-转化为难溶于水的TcO2,同时得到一种难溶于水的弱碱,该反应的离子方程式为_______________________________。
(Ⅰ)某盐有原子序数处于前20的三种元素组成,相对分子质量为98,其焰色反应为紫色(透过蓝色的钴玻璃)。向此溶液中滴入少量盐酸时,产生白色沉淀,继续加入过量盐酸时,白色沉淀消失,再滴入过量氨水,又产生白色沉淀。
(1)三种元素中原子序数最小的简单离子的离子结构示意图 ,
(2)该盐的化学式为 ,
(3)该盐溶液滴入少量盐酸的离子方程式 。
(Ⅱ)某二元化合物A是一红棕色难溶物质,温度超过60℃,分解生成红色金属B和无色气体单质C,且两种单质的物质的量之比为2:1,将A与盐酸反应也同样产生气体C。在一定条件下可以用H3PO2与CuSO4溶液混合制备A,经鉴定反应后的溶液是磷酸和硫酸的混合物。且A能在氯气中燃烧。
(1)A的化学式为 ,
(2)写出用H3PO2与CuSO4溶液混合制备A的反应方程式 ;
(3)写出A在氯气中燃烧的方程式 ;
(4)有人认为还有一种组成元素与A相同的二元化合物, 若此物质为离子化合物,则电子式为 ;
(5)A与盐酸能反应的原因 。
海水是巨大的资源宝库.如图1是从海水中提取食盐和溴的主要流程.

(1)粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质.如图2是粗盐提纯的操作流程.

提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、饱和NaCl溶液.
①除去溶液I中的MgCl2、CaCl2、Na2SO4,从提供的试剂中选出a所代表的试剂,按滴加顺序依次为:过量的NaOH溶液、
②如何证明操作①中NaOH溶液已经过量?
③蒸发过程所用的主要仪器有:铁架台、酒精灯、 、 ;
(2)某同学欲四氯化碳萃取较高浓度的溴水中的溴,经振荡并在铁架台上静置分层后,分离出四氯化碳层的操作:
(3)工业上将较高浓度的溴水经进一步处理得到工业溴.某研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为 59℃,微溶于水,有毒性和强腐蚀性.水的沸点为100℃.他们参观生产过程后,设计了如图3装置简图:

①图中仪器B的名称: ②温度计水银球的位置:
③实验装置气密性良好,要达到提纯溴的目的,收集溴时温度计应控制的温度为:
试题篮
()