为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。可选用试剂:KSCN溶液、NaOH溶液、氯水、KMnO4 溶液。(1)请完成下表: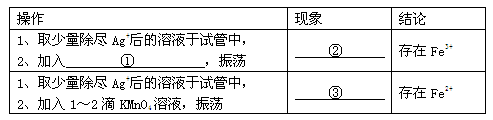
【实验结论】Fe的氧化产物为存在Fe2+和Fe3+
Ⅱ.AgNO3的热稳定性
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束以后,试管中残留固体为黑色。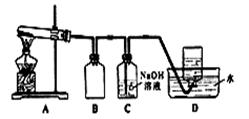
(2)装置B的作用是 。
(3)经小组讨论并验证该无色气体为O2,其验证方法是 。
(4)【查阅资料】Ag2O和Ag的粉末均为黑色;Ag2O可溶于氨水。
【提出假设】试管中残留的黑色固体可能是:①Ag;②Ag2O;③Ag和Ag2O。
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验。
| 实验编号 |
操作 |
现象 |
| a |
加入足量氨水,振荡 |
黑色固体不溶解 |
| b |
加入足量稀硝酸,振荡 |
黑色固体溶解,并有气体产生 |
【实验评价】根据上述实验,不能确定固体产物成分的实验是 (填实验编号)。
【实验结论】根据上述实验结果,得出AgNO3固体受热分解的方程式为 。
【实验拓展】测得两组数据:
①取2.0gAgNO3样品充分受热分解,收集到气体体积为56mL;
②取2.0gAgNO3样品充分受热分解,完全分解后测得残留固体产物质量为1.2g;请你选择其中一组数
据,计算样品中AgNO3的百分含量为 。
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验: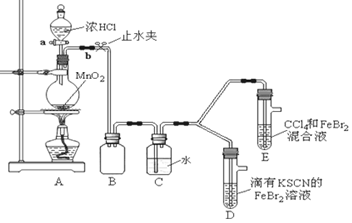
(1)①检查气体发生装置A的气密性的操作是 _________________ 。
②整套实验装置存在一处明显的不足,请指出 。
(2)用改正后的装置进行实验,实验过程如下:
| 实验操作 |
实验现象 |
结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 |
D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,CCl4层无明显变化。 |
Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
| ⅰ.(SCN)2性质与卤素单质类似。氧化性:Cl2>(SCN)2。 ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点约5℃,与水发生水解反应。 ⅲ.AgClO、AgBrO均可溶于水。 |
①请解释Cl2过量时D中溶液红色褪去的原因 ,
请设计简单实验证明上述解释 。
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,观察到的现象是________。
③将少量BrCl通入到碘化钾溶液中,该反应的化学方程式为 。
不同镜子背后的金属镀层可能是不同的,目前使用的金属主要有两种。为研究金属镀层的成分,某小组分别收集了两块镜子背面的金属镀层粉末甲和乙,按下述实验操作步骤进行实验:
| 金属 |
实验操作 |
实验现象 |
| 甲 |
①取少量粉末,加入过量浓硝酸 ②向上述溶液中加入几滴NaCl溶液 |
粉末溶解,有红棕色气体产生 有白色沉淀生成 |
| 乙 |
③取少量粉末,加入足量NaOH溶液 ④向上述溶液中逐滴加入稀盐酸 ⑤继续加入过量的稀盐酸 |
粉末溶解,有气泡产生 有白色沉淀生成 _____________________ |
根据实验,回答下列问题:
(1)甲与浓硝酸反应的化学方程式是__________________。
(2)实验操作⑤的实验现象是 ,乙溶解在NaOH溶液中反应的离子方程式是 。
(3)欲“比较甲和乙的金属活动性顺序”,实验的操作步骤是________________________。
将已去除表面氧化物的铁钉(碳素钢)放入冷浓 硫酸中加热,充分应后得到溶液X并收集到气体Y。
硫酸中加热,充分应后得到溶液X并收集到气体Y。
(1)甲同学认为X中除 外还可能含有
外还可能含有 。若要确认其中的
。若要确认其中的 ,应选用 (填序号)。
,应选用 (填序号)。
| A.KSCN溶液和氯水 | B.铁粉和KSCN溶液 | C.浓氨水 | D.酸性 溶液 溶液 |
丙同学认为气体Y中除 外还可能含量有
外还可能含量有 和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
(2)装置B中试剂的作用是 。
(3)认为 气体Y中还含有Q的理由是 (用化学方程式表示)。
气体Y中还含有Q的理由是 (用化学方程式表示)。
(4)为确认Q的存在,需在装置中添加M于 (选填序号)。
a. A之前 b.A-B间 c.B-C间 d.C-D间
(5)如果气体Y中含有 ,预计实验现象应是 。
,预计实验现象应是 。
FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:
I.实验需要90mL 0.10mol·L-1FeBr2溶液
(1)配制FeBr2溶液除烧杯、量筒、胶头滴管外还需的玻璃仪器是________。
(2)下列有关配制过程中说法错误的是________(填序号)。
a.用托盘天平称量质量为1.944g的FeBr2
b.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
II.探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
(3)请你完成下表,验证假设
| 实验步骤、预期现象 |
结论 |
| ①向溶液中加入四氯化碳,操作 现象 |
假设1正确 |
| ②向溶液中另入 现象 |
假设2正确 |
若假设1正确,从实验①分离出Br2的实验操作名称是
(4)若在50mL上述FeBr2溶液通入标准状况下112mL Cl2,反应的离子方程式为
海水中含有丰富的化学元素,下面是某化工厂从海水中提取NaCl、Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及综合利用的生产流程简图:

请回答:
(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:
A.盐酸 B.氯化钡溶液 C.氢氧化钠溶液 D.碳酸钠溶液
则加入试剂的顺序是(填编号) 。
(2)Mg(OH) 2中加入盐酸后,要获得MgCl 2•6H 2O晶体,需要进行的实验操作依次 。
A.蒸馏 B.灼烧 C.过滤 D.蒸发 E.冷却结晶
(3)目前工业上主要采用离子交换膜法电解饱和食盐水,下列关于离子交换膜电解槽的叙述错误的是 .
A.精制饱和食盐水进入阳极室 B.纯水(加少量NaOH)进入阴极室
C.阴极产物为氢氧化钠和氢气 D.电解槽的阳极用金属铁网制成
(4)写出电解饱和NaCl溶液的离子方程式:
(5) 利用MgCl 2•6H 2O可制得无水氯化镁,应采取的措施是
(6) 用热空气吹出的溴蒸气可以用亚硫酸钠溶液吸收,写出反应的化学方程式:
钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、
SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂
LiFePO4)的工业流程如下图所示: 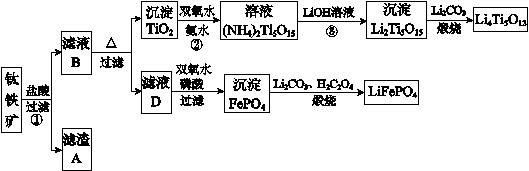
已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl—= Fe2++ TiOCl42—+2H2O
(1)化合物FeTiO3中铁元素的化合价是_______。
(2)滤渣A的成分是_______。
(3)滤液B中TiOCl42-和水反应转化生成TiO2的离子方程式是_______ 。
(4)反应②中固体TiO2转化成(NH4)2Ti5O15 溶液 时,Ti元素的浸出率与反应温度的关系如下图所示。反应温度过高时,Ti元素浸出率下降的 原因_ 。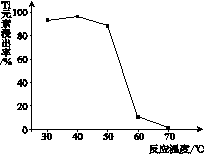
(5)反应③的化学方程式是_______ 。
(6)由滤液D制备LiFePO4的过程中,所需 17%双氧水与H2C2O4的质量比是_______。
(7)若采用钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)作电极组成电池,其工作原理为:Li4Ti5O12 + 3LiFePO4 Li7Ti5O12 + 3FePO4 该电池充电时阳极反应式是:_______ 。
Li7Ti5O12 + 3FePO4 该电池充电时阳极反应式是:_______ 。
某研究性实验小组欲验证浓硝酸在与Cu、Ag合金的反应过程中除生成NO2气体外,还会有少量NO生成、并测定Cu、Ag合金中Cu的质量分数。查阅相关资料表明:“常温下,NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。”为此,他们设计了如下图所示的装置。
请回答下列问题
(1)写出A中Cu与HNO3反应可能的化学方程式 。
(2)实验开始前先打开A部分的活塞K1,持续通入一段时间的氮气再关闭K1,其目的是 ;装置中B瓶的作用是 。
(3)停止反应后,打开D中的活塞K2并通入O2,若有NO生成,则D中出现的现象是 ;实验发现,通入的O2温度高低对实验现象有较大影响,为便于观察应通入(填“热”或“冷”) 的O2。
(4)为减小实验误差,在A中反应完成和D中出现现象后,还应继续进行的操作是
。
(5)实验测得如下数据:实验前,Cu、Ag合金的质量:15.0g,浓HNO3:40mL 13.5 mol·L-1;实验后A溶液:V=40mL c(H+)=1.0 mol·L-1。假设反应中HNO3既无挥发也无分解,则:
①参加反应的HNO3的物质的量为 mol。
②若已测出反应后E装置的生成物中含氮元素的质量,则为确定合金中Cu的质量分数还需测定的数据是 。
(6)若已知Cu、Ag合金的质量为m g,且溶解完全。请利用A装置中反应后的溶液进行简单的操作,以确定合金中Cu的质量分数,其实验过程为 。
某化学研究性学习小组讨论Fe3+溶液和SO32-溶液之间发生怎样的反应,提出了两种可能,写出预计反应的离子方程式:
一是发生氧化还原反应 ,二是发生彻底互促水解反应 。
为了证明发生怎样的反应,同学们设计并进行如下实验,请填写下列空白:
实验Ⅰ:取5 mL FeCl3浓溶液于试管中,逐滴加入某Na2SO3浓溶液至过量,观察到无气泡产生,无沉淀生成,但溶液颜色最终变为红褐色。这种红褐色液体是 。
向红褐色液体中逐滴加入稀盐酸至过量,可观察到溶液最终变为黄色。将所得溶液加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是 。
实验Ⅱ:将FeCl3和Na2SO3溶液分别稀释后,重复实验Ⅰ,产生的现象完全相同。
同学们由上述实验得出的结论是 。
指导老师看过上述实验步骤后认为该设计有缺陷,应在开始实验前对某主要药品进行检验,该主要药品为 ;检验的目的是 。
研究性学习小组对某硫酸亚铁晶体(FeSO4•xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。
(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有 。
(2)实验中要持续通入氮气,否则测出的x会 (填“偏大”、“偏小”或“不变”)。
(3)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3。
(4)从理论上分析得出硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式 。
(5)装置D球形干燥管的作用 。
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4•xH2O)进行热分解,获得相关数据,绘制成固体质量——分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4•xH2O中的x= 。
I、II两学习小组分别进行探究性的实验:
I组:为了分别研究SO2和Cl2的性质,设计了如图所示的实验装置。

(1)若从左端分别通入SO2和Cl2,则装置I中观察到的现象是否相同? (填“相同”或“不相同”);当通入SO2时,装置III中发生反应的离子方程式为 ;该反应中SO2表现出 性。
(2)若装置II中装有5.0mL 1.0×10-3mol·L-1碘水,当通入足量Cl2完全反应后,共转移了5.0×10-5mol电子,则该反应的化学方程式为 。
(3)你认为乙组设计的装置是否有不足之处? (填“有”或“无”)。如果有,请写出改进方法: (如果无,此空不答)。
II组:为了探究Cl2和SO2同时通入H2O中发生的反应,设计了如图所示的实验装置。
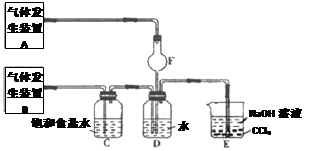
(1)气体发生装置A中产生的气体化学式为 。
(2)装置D中发生反应的化学方程式为 ;在装置D反应后所得溶液中加入BaCl2溶液,观察到的现象是 。
(3)装置C中饱和食盐水的作用是 ;装置E的作用是 。
某化学兴趣小组的同学利用下图所示实验装置进行某些气体的制备、性质等实验(图中夹持装置有省略)。请按要求填空:
Ⅰ.探究氯气与氨气的反应
(1)为制取干燥氨气,可将装置C与________(填装置编号)连接;装置C中的烧瓶内固体宜选用________。
a.碱石灰 b.氯化钙
c.五氧化二磷 d.生石灰
(2)装置A、E、E连接可制取纯净、干燥的氯气,则两个E装置内的药品依次是________________。
(3)装置F可用于探究氯气与氨气(已知氯气与氨气可发生反应:3Cl2+2NH3=N2+6HCl)的反应。实验时打开弹簧夹1、3,关闭2,先向烧瓶中通入________,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体。实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中的阳离子_____________________________________。
Ⅱ.探究某些物质的性质
(4)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱,能证明结论的实验现象是_______________________________________________________。
(5)若利用装置A、E进行乙烯与溴水反应的实验,写出反应的化学方程式_________________________________________
(6)将装置B、C分别与F相连后,进行H2S与SO2反应的实验。F的烧瓶中发生反应的化学方程式为______________________;F的烧杯所起的作用是_________________________________________________________________。
Ⅰ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色。
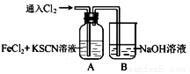
(1)B中反应的离子方程式是 ;
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验。取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在 ;
(3)资料显示:SCN -的电子式为 。甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究。
。甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究。
①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN﹣中被氧化的元素是 ;
②甲同学通过实验证明了SCN﹣中氮元素转化为NO3﹣,已知SCN﹣中碳元素没有被氧化,若SCN﹣与Cl2反应生成1mol CO2,则转移电子的物质的量是 mol;
Ⅱ.8.12天津港特大爆炸事故现场有700吨左右氰化钠,氰化钠剧毒。有少量因爆炸冲击发生泄漏。这些泄露的氰化钠可通过喷洒氧化剂双氧水的方式来处理,以减轻污染。
请写出NaCN的电子式___________,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3﹣,同时放出NH3,该反应的离子方程式为 。
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行以下探究活动:
【探究一】
(1)将已除去表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是____________________________。
(2)另取铁钉放入一定量浓硫酸中加热,充分反应后得到溶液X并收集到干燥气体Y。
①甲同学认为X中可能含有Fe3+和Fe2+。若要确认其中的Fe2+,应选用__________(填序号)。
a.KSCN溶液 b.铁氰化钾溶液 c.盐酸
②乙同学取448mL(标准状况)气体Y通入足量溴水中,发生反应的离子方程式为___ _,充分反应后,加入足量BaC12溶液,经适当操作后得干燥固体2.33g。可推知气体Y中SO2的体积分数为__________。
【探究二】
据探究一所测SO2的体积分数,丙同学认为气体Y中可能还含有CO2和Q气体,因此设计了下列实验装置(图中夹持仪器省略,实验前已将装置中空气排尽)进一步探究。
(3)装置A中的现象是 ,其作用是________________。

(4)为判断CO2是否存在,需将装置M添加在______________(填序号);
a.A之前 b.A~B之间 c.B-C之间 d.C~D之间
若存在CO2,则产生CO2气体的反应中氧化剂与还原剂的物质的量之比为__________。
(5)若C中固体变红,D中固体变蓝,则Q是___________(填化学式),产生该气体的原因是__________。
(6)若某气体可能由CO2、SO2、H2中的一种或多种组成,经测定其中氧的质量分数为50%,则该气体的组成可能为__________(填序号)。
a.SO2 b.H2、SO2 c.H2、 CO2 d.CO2、SO2 e.CO2、SO2、H2
用如图所示装置进行实验(夹持装置已略去)。请回答下列问题:
(1)若A中为浓硝酸,B中为铜单质,C中为氢氧化钠溶液。将浓硝酸滴入B中,则B中发生反应的化学方程式为。
(2)若A中为浓氨水,B中为生石灰,C中为明矾溶液。
①将浓氨水逐滴滴入B中,可产生大量氨气,原因可能是(填序号)。
a.生石灰和浓氨水反应产生氨气,氨气易溶于水
b.生石灰和水反应,消耗水,使氨气的溶解量减少
c.反应放出大量热,使氨气在水中的溶解度明显降低
②C中通入过量氨气时,相应的离子方程式为。
(3)若A中为水,B中为过氧化钠,C中为酸性淀粉碘化钾溶液,将水滴入B中后,B中的实验现象为;若C中溶液变为蓝色,则C中发生反应的离子方程式为。
试题篮
()