(14分)化合物A为一种常见金属元素与一种常见非金属元素组成的化合物,阳离子与阴离子的个数比为2:3。K为常见固态非金属单质,J为常见气态单质。其余为化合物,其中I、F在常温下为液态,C为有臭鸡蛋气味气体、D为刺激性气体,H无色无味气体,B为白色胶状沉淀,L为氯碱工业中的常见产品。F的浓溶液与K加热可生成D和H。(部分生成物未标出)
(1)写出H的电子式 。
(2)写出下列物质的化学式: E ,J 。
(3)写出下列变化的化学方程式:
A + I → B + C ;
F的浓溶液与K加热可生成D和H 。
(4)写出下列变化的离子方程式:
B中加入L的水溶液 ;
G的水溶液中通入过量的H 。
(14分)下图中的每个方格表示有关的一种反应物或生成物。其中A、C为无色气体。
完成下列问题:
(1)物质M可以是 或 ,C是 ,F是 。
(2)淡黄色粉末的电子式是: 。
(3)反应①的化学方程式: 。
(4)反应②的离子方程式: 。
(本题包括2部分,共14分)
Ⅰ、X、Y、Z、W均为短周期元素组成的单质或化合物。在一定条件下有如下转化关系:X+Y→Z+W
(1)若构成X的阳、阴离子个数比为1︰2,且构成X的阳、阴离子中分别含有18个和10个电子,构成Z的阴、阳离子中均含有10个电子。则Z的电子式为 。
(2)若X、Y、Z、W四种物质均为分子,且X分子中含18个电子,Y、Z分子中均含有10个电子,单质W分子中含有16个电子。则此化学反应的类型为 。
(3)若X、W均为单质,Y、Z均为氧化物且Y、Z中氧的质量分数分别为50%和40%。则该反应的化学方程式为 。
(4)若X、Y、Z、W均为非金属氧化物,X的式量比Z的式量小16,Y的式量比W的式量大16,Y是光化学烟雾的主要“元凶”,则该反应的化学方程式为 。
Ⅱ、(6分)我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,下图是某化工厂对海水资源综合利用的示意图:
请根据以上信息回答下列问题:
(1)写出N的化学式和B的名称:N 、B 。
(2)写出反应②的化学方程式并用双线桥表示电子转移情况:
(3)写出反应③的离子方程式:
下图所示各物质是由短周期部分元素组成的单质或其化合物,图中部分反应条件及物质未列出。已知:A、C、D、F均为单质,C、E、F、G常温下是气体,J为白色沉淀,既能溶于B,又能溶于E;物质B、G可以使湿润的红色石蕊试纸变蓝,且B的焰色反应呈黄色。反应④是化肥工业的重要反应。
请回答下列问题:
(1)A的元素在元素周期表中的位置是 ,物质B的电子式为 。
(2)上述反应①~⑥中,属于化合反应的是 ,反应⑤的离子方程式为 。
(3)在I的水溶液滴加B溶液至过量的过程中,所观察到的现象为 。
下图 分别代表有关反应中的一种物质,请填写以下空白。
分别代表有关反应中的一种物质,请填写以下空白。
(1)已知①中阴阳离子个数比为1:1,则的化学式是 、②的电子式为 。
(2)上图中涉及的氧化还原反应共有 个。
(3)与反应的化学方程式为 。
(4)⑧与⑨反应的化学方程式是 。
(5)一定条件下,将2amL和的混合气体用排水法收集,得到amL气体,则原混合气体中和的体积比为 。
甲、乙、丙为常见单质。A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,C能使品红溶液褪色。在一定条件下,各物质相互转化关系如图所示。
请回答下列问题:
(1)用化学式表示:丙为__________,H为__________。
(2)A的电子式为___________________________________________________。
(3)电解E的水溶液时,E起到的作用是_______________________________。
(4)写出B+C―→D的化学方程式:__________________________________;
写出E+G―→F的离子方程式:____________________________________。
图中字母所代表的物质均为中学化学常见物质。其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料;常温下C、D、H为气体单质。单质E、M、N为金属,N是地壳中含量最大的金属元素。Y是红褐色沉淀。这些物质在一定条件下存在如下转化 关系,其中有些反应物或生成物已经略去。试回答下列问题:
(1)Z→L反应的名称是 。
(2)K的电子式为 。
(3) 写出B→F的离子方程式 。
(4) 写出K与CO2反应的化学方程式 。
(5) Y与NaClO和B的混合溶液作用,是制备绿色水处理剂(Na2MO4)的一种方法,请写出该反应的离子方程式 。
图中X、Y、Z为单质,其他为化合物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁,E是不溶于水的酸性氧化物,能与氢氟酸反应。
回答下列问题:
(1)组成单质Y的元素在周期表中的位置是________;M中存在的化学键类型为________;R的化学式是________。
(2)一定条件下,Z与H2反应生成ZH4,ZH4的电子式为______。
(3)已知A与1 mol Al反应转化为X时(所有物质均为固体),放出a kJ热量。写出该反应的热化学方程式:___________________。
(4)写出A和D的稀溶液反应生成G的离子方程式:__________。
(5)向含4mol D的稀溶液中,逐渐加入X粉末至过量。假设生成的气体只有一种,请在坐标系中画出n(X2+)随n(X)变化的示意图,并标出n(X2+)的最大值。
物质A经下图所示的过程转化为含氧酸D,D为强酸,请回答下列问题:
(1)若A在常温下为气体单质则回答:
①A、C的化学式分别是:A________;C________。
②将C通入水溶液中,反应化学方程式为________________________。
若仅A、B在常温下为气体且为化合物,则回答:
①A的化学式是:A________。
②B生成C的化学方程式为________________________。
③一定条件下碳单质与D反应的方程式为________________________,该反应中D起到的
作用是________________.
(3)若A在常温下为固体单质则回答:
①D的化学式是________;
②向含2mol D的浓溶液中加入足量的Cu加热,标准状况下产生的气体体积_______22.4L
(填“大于”“等于”或“小于”),原因为_________________________________。
(14分)A、J是日常生活中常见的两种金属,这两种金属和NaOH溶液组成原电池,A作负极;F常温下是气体,各物质有如图所示的转化关系(部分产物及条件略去)。
请回答以下问题:
(1)写出原电池的负极反应方程式
(2)常温时pH=12的C溶液中,溶质的阳离子与溶质的阴离子浓度之差为 (写出计算式);相同条件下,等浓度的c溶液与CH3COONa溶液中,C的阴离子与CH3COO一浓度的大小关系:前者 后者(用“>”“<”或“=”表示)。
(3)写出②的化学方程式
(4)含A元素的某盐x常作净水剂,x做焰色反应时,透过
蓝色的钴玻璃观察火焰呈紫色。
①x的水溶液与NaHCO3溶液混合,反应的离子方程式为
②500mL X的溶液与Ba(OH)2反应生成沉淀的质量与加入Ba(OH)2物质的量的关系如图,x晶体的俗名为 ;其溶液的物质的量浓度为 mol/L。
四种短周期元素A、B、C、D的性质或结构信息如下:
信息① 原子半径大小:A>B>C>D
信息② 四种元素之间形成的某三种分子的比例模型及部分性质:


请根据上述信息回答下列问题。
(1)B元素在周期表中的位置 ;
(2)BC2分子的电子式 ;
(3)A元素的单质与物质甲发生反应的离子方程式 ;
(4)丙的钠盐溶液呈______性,用化学用语表示其原因 ;
(5)物质丁的元素组成和甲相同,丁分子具有18电子结构。向盛有一定浓度丁溶液的试管中,逐滴加入用少量稀硫酸酸化的硫酸亚铁溶液。滴加过程中的现象是:
①浅绿色溶液变成深棕黄色;
②有少量气泡出现(经验证是氧气),片刻后反应变得剧烈,并放出较多热量,继续滴加溶液,静置一段时间;
③试管底部出现红褐色沉淀。向浊液中再滴入稀硫酸,沉淀溶解,溶液呈黄色。
请用化学方程式或离子方程式及必要的文字解释①、②、③中加点的字。
① ;
② ;
;
③ 。
物质A、B、C、D、E、F、G、H、I、J有如图所示的转化关系。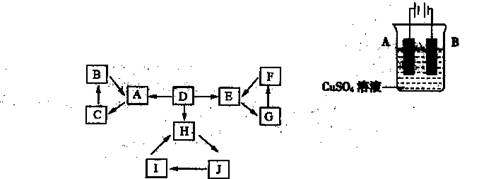
图中所有物质均由短周期元素组成,且每个小三角形内的三种物质均至少含有第三周期中的一种相同元素。其它信息见下表:
| 编号 |
信 息 |
| 1 |
D为地壳中含量最高的元素组成的单质 |
| 2 |
E为酸性气态氧化物 |
| 3 |
F的浓溶液常做干燥剂 |
| 4 |
H为淡黄色固体化合物 |
| 5 |
电解饱和J溶液是工业重要反应 |
| 6 |
C为离子化合物,阴、阳离子均含有金属元素 |
(1)写出G的化学式: ,指出H中化学键的类型: 。
(2)常温下测得一定浓度的C溶液的pH=10,用离子方程式表示其原因 。
(3)写出与H相对分子质量相同,且它们的阴离子所含的电子数、电荷数也均相同的化合物的化学式 。
(4)写出C溶液中通入过量CO2的化学方程式: 。 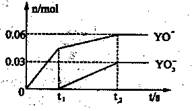
(5)通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中三种含Y元素的离子,其中两种离子物质的量(n)与反应时间(t)的变化示意图如上图所示,写出该反应的离子方程式是 ,该苛性钾溶液中KOH的质量是 g。
X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如下图所示(水及部分产物已略去)。
(1)若X为金属单质,W是某强酸的稀溶液。X与少量W反应生成Z的离子方程式为 ,向Y溶液中加入某种试剂 (填试剂名称),若溶液出现血红色,即可判断Y溶液中阳离子的存在。
(2)若X、Y为正盐,X的水溶液显酸性,W为NaOH溶液,写出Y与X在水溶液中转化为Z的离子反应方程式 。
(3)若X为强碱,常温下W为有刺激性气味的气态氧化物。常温时,将Z的水溶液露置于空气中,溶液的PH变化是 (填“变大”、“变小”、“不变”。不考虑水的挥发),其原因是_________ (用简要的文字说明,并写出离子方程式)。
(4)室温下,若用 的NaOH溶液滴定
的NaOH溶液滴定 mo1/L HA溶液,滴定曲线如图所示,则a、b、c、d四点溶液中水的电离程度最大的是 点;a点溶液中离子浓度的大小顺序为 ;少量c点溶液于试管中,再滴加0.1mo1/L盐酸至中性,此时溶液中除H+、OH-外 ,离子浓度的大小顺序为 。
mo1/L HA溶液,滴定曲线如图所示,则a、b、c、d四点溶液中水的电离程度最大的是 点;a点溶液中离子浓度的大小顺序为 ;少量c点溶液于试管中,再滴加0.1mo1/L盐酸至中性,此时溶液中除H+、OH-外 ,离子浓度的大小顺序为 。
A、B、C、D、E为五种元素的单质,其余为化合物。其中只有E为金属元素,五种元素的原子序数按B、D、C、A、E顺序依次增大,D、C元素在周期表中位置相邻,在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙化合物,C和D化合可得丁。已知乙、丙每个分子中均含有10个电子,下图为相互转化关系:
请回答下列问题:
(1)下面是周期表的一部分,请将A、C、E用元素符号填在相应的位置上。
(2)写出实验室制取A反应的离子方程式_______________。
(3)戊的分子式为_______。B与D形成的原子个数比为2:1的化合物中,D原子最外层为8电子结构,请写出该化合物的电子式______。
(4)A与丙常温下发生反应生成甲与单质D,该反应的化学方程式_________。
(5)8gE在A中燃烧放出热量QkJ,写出该反应热化学方程式________(热量是常温下测定的)。
(6)实验室配制庚溶液的实验方法是________。
下表为长式周期表的一部分,其中的序号代表对应的元素。
| ① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
② |
|
|
|
|
|
|
|
|
|
|
|
③ |
④ |
⑤ |
⑥ |
|
| |
⑦ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑧ |
|
| |
|
|
|
|
|
|
⑨ |
|
|
⑩ |
|
|
|
|
|
|
|
(1)上表中元素⑨对应的二价阳离子未成对电子数目为______________。
(2)由元素③形成的一种不导电单质晶体,其名称为__________,该单质晶体类型为_________________,
在该晶体中,元素③的原子个数与形成的共价键键数之比为 。
(3)元素⑦与①⑤形成的化合物的化学键类型有_________ __________;根据对角线规则,元素②与⑧形成的物质为___________(填“离子化合物”或“共价化合物”)。
(4)元素④与元素①形成的X分子的空间构型为__________,用氢键表示式写出X分子间存在的氢键
_________________________。
(5)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是__________________________________________________。
(6)④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,元素④被还原到最低价,该反应的化学方程式为__________________________________________。
(7)元素⑩的蓝色硫酸盐溶液显______性,用离子方程式表示其原因____________。
试题篮
()