随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。根据判断出的元素回答下列问题: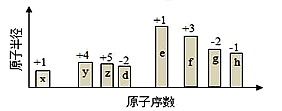
(1)f 在元素周期表的位置是__________。
(2)比较y、g、h最高价氧化物对应水化物的酸性强弱是:_______>________>_______。(用化学式表示)
(3)由表中两种元素的原子按1:1组成的化合物A和B,A中既含离子键又含非极性共价键,其电子式为__________;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为____________。(填序号)
| A.MnO2 | B.FeCl3 | C.Na2SO3 | D.KMnO4 |
 (4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应: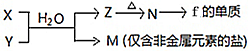
①
 X溶液与Y溶液反应的离子方程式为__________________________
X溶液与Y溶液反应的离子方程式为__________________________
②常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至________________
(5)上述元素可组成盐R:zx4f(gd4)2,向盛有10 mL 1mol·L-1 R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀的物质的量随NaOH溶液体积变化如图所示: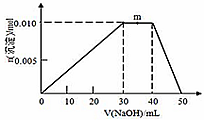
①写出m点反应的离子方程式____________。
②若R溶液中改加20mL 1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为____________mol。
海水开发利用的部分过程如图所示。下列说法错误的是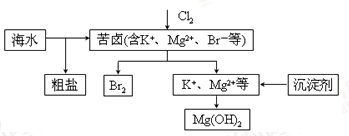
| A.向苦卤中通入Cl2是为了提取溴 |
| B.粗盐可采用除杂和重结晶等过程提纯 |
| C.工业生产中常选用NaOH作为沉淀剂 |
| D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 |
某溶液中有Fe3+、Mg2+、Fe2+和Al3+四种阳离子,若向其中加入过量的氢氧化钠溶液,搅拌后,再加入过量的盐酸,溶液中大量减少的阳离子是( )
| A.Fe3+ | B.Mg2+ | C.Fe2+ | D.Al3+ |
大多数非金属元素有含氧酸根离子,某些金属元素也有含氧酸根离子:
MnO4-、MnO42-、Cr2O72-等。某无机盐M是一种优良的氧化剂,为确定其化学式,某小组设计并完成了如下实验:
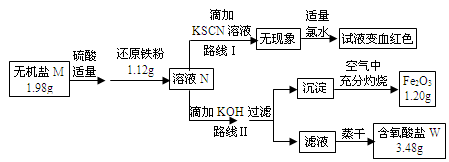
已知:
①无机盐M仅由钾离子和一种含氧酸根组成,其原子个数比为2:1:4
②如图中,将1.98g该无机盐溶于水,滴加适量稀硫酸后,再加入1.12g还原铁粉,整个过程无气体生成,恰好完全反应得混合溶液N.
③该小组同学将溶液N分为二等份,分别按路线Ⅰ、路线Ⅱ进行实验.
④在路线Ⅱ中,首先向溶液N中滴加适量KOH至元素X刚好沉淀完全,过滤后将沉淀在空气中充分灼烧得纯净的Fe2O3粉末1.20g;再将滤液在一定条件下蒸干,只得到3.48g纯净的不含结晶水的正盐W.
请按要求回答下列问题:
(1)由路线Ⅰ的现象可知,溶液N中含有的阳离子是 .
(2)由实验流程图可推得,含氧酸盐W的化学式是 ;由路线Ⅱ可知,1.98g无机盐M中所含钾元素的质量为 g.
(3)无机盐M与1.12g还原铁粉恰好完全反应生成溶液N的化学反应方程为 .
FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:
I.实验需要90mL 0.10mol·L-1FeBr2溶液
(1)配制FeBr2溶液除烧杯、量筒、胶头滴管外还需的玻璃仪器是________。
(2)下列有关配制过程中说法错误的是________(填序号)。
a.用托盘天平称量质量为1.944g的FeBr2
b.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
II.探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
(3)请你完成下表,验证假设
| 实验步骤、预期现象 |
结论 |
| ①向溶液中加入四氯化碳,操作 现象 |
假设1正确 |
| ②向溶液中另入 现象 |
假设2正确 |
若假设1正确,从实验①分离出Br2的实验操作名称是
(4)若在50mL上述FeBr2溶液通入标准状况下112mL Cl2,反应的离子方程式为
甲、乙、丙、X是中学化学中常见的4种物质,其转化关系符合如图.其中甲和X可能是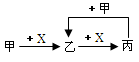
| A.甲为Fe、X为Cl2 |
| B.甲为S、X为O2 |
| C.甲为SO2、X为NaOH溶液 |
| D.甲为AlCl3溶液、X为NH3·H2O |
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
| A |
铝具有强还原性 |
可以通过置换反应产生氢气 |
| B |
二氧化硅不与任何酸反应 |
可用石英制造耐酸容器 |
| C[ |
浓H2SO4有吸水性 |
浓H2SO4可用于干燥NH3 |
| D |
Fe2O3溶于酸 |
可作红色涂料 |
金属及其化合物在化学中扮演着重要的角色,同学们应该熟练掌握它们的性质。
(1)钠与水反应时,钠漂浮在水面上。甲同学用刺有小孔的铝箔将4.6g的钠包裹,而后投入到水中,使钠沉入水底与水(足量)反应。该过程中发生反应的离子方程式有___________,充分反应生成的气体体积_________(填“大于”、“小于”或“等于”)2.24L(标准状况下)。
(2)乙同学将足量的铜粉投入到500mL18.4mol/L的浓硫酸中并加热制取SO2,写出该反应的化学方程式__________,生成的SO2物质的量小于4.6mol的原因是_____________。
(3)丙同学向MgCl2、AlCl3的混合溶液中逐滴滴加2mol/L的NaOH溶液,并绘制出沉淀与NaOH溶液体积的关系图像如图,则a=_________,b=________。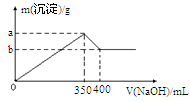
向含有Fe2+、Fe3+、Mg2+、NH4+的水溶液中,加入足量的Na2O2固体,充分反应后再加入过量的稀盐酸,上述离子数目没有变化的是
| A.Fe2+ | B.NH4+ | C.Fe3+ | D.Mg2+ |
实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物呈棕红色,易潮解,100℃左右时会升华。如图是两个学生设计的实验装置,左边的反应装置相同,而右边的产品收集装置不同,分别如装置Ⅰ和装置II所示。已知B中反应的化学方程式为MnO2+4HCl(浓)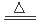 MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑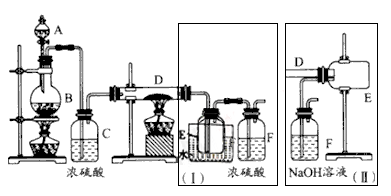
(1)C中浓硫酸的作用是___________________。
(2)D中的反应开始前,要先通入一段时间的氯气,其原因是____________________。
(3)D中反应的化学方程式为________________________。
(4)装置Ⅰ的主要缺点是____________________________。
(5)装置II的主要缺点是___________________________。
下列除杂方案正确的是
| 选项 |
被提纯的物质 |
杂质 |
除杂试剂 |
除杂方法 |
| A |
CO(g) |
CO2(g) |
饱和NaHCO3溶液、浓硫酸 |
洗气 |
| B |
FeCl2(aq) |
CuCl2 |
铁粉 |
过滤 |
| C |
Cl2(g) |
HCl(g) |
NaOH溶液、浓硫酸 |
洗气 |
| D |
NaHCO3(aq) |
Na2CO3(aq) |
盐酸 |
— |
下列对物质的用途及解释都正确的是
| 选项 |
物质 |
用途 |
解释 |
| A |
SO2 |
食品漂白剂 |
SO2具有还原性 |
| B |
NaClO |
消毒剂 |
NaClO具有强氧化性,能杀灭细菌 |
| C |
Na2CO3 |
中和过多胃酸 |
Na2CO3属于碱 |
| D |
浓硫酸 |
干燥剂 |
浓硫酸具有脱水性 |
下列物质组别,不属于同素异形体的是
| A.石墨和石墨烯 | B.O2和O3 | C.H2O和H2O2 | D.单斜硫和斜方硫 |
试题篮
()