某有机物0.1mol,与标准状况下5.6L氧气充分反应后,产物为CO、CO2、H2O的混合气体。将此混合气体通过浓硫酸,浓硫酸增重5.4g,再通过灼热氧化铜粉末,氧化铜质量减少1.6g;最后通过足量碱石灰,碱石灰增重8.8g。求该有机物的分子式。(书写计算过程)
A是一种含碳、氢、氧三种元素的有机化合物。已知:A中碳的质量分数为44.1%,氢的质量分数为8.82%;A只含一种官能团,且每个碳原子上最多只连一个官能团;A能与乙酸发生酯化反应,但不能在两个相邻碳原子上发生消去反应。通过计算求:
(1)A的分子式是_____________(写出计算过程),其结构简式是____________________。
(2)写出A与乙酸反应的化学方程式:________________________________________。
(3)27.2gA在空气中充分燃烧时至少需要空气(标况下)多少L;生成的CO2用170ml 10mol/L的NaOH溶液吸收,反应后溶液中溶质的成分是什么,其物质的量各是多少?
(4)写出所有满足下列3个条件的A的同分异构体的结构简式。①属直链化合物;②与A具有相同的官能团;③每个碳原子上最多只连一个官能团。写出这些同分异构体的结构简式。
5.8g有机物完全燃烧,只生成CO2和H2O蒸气,其体积比为1:1(同压同温),若把它们通过碱石灰,碱石灰增加18.6g,同量的有机物与0.1mol乙酸完全发生酯化反应.又知该有机物对空气的相对密度为2。(简要写出求算过程)
求:(1)有机物的相对分子质量;
(2)有机物的分子式;
(3)有机物的结构简式 。
(10分)某有机物的蒸气密度是相同状况下甲烷密度的3.625倍。把1.16g该有机物在氧气中充分燃烧,将生成的混合物依次通过足量浓硫酸和碱石灰,分别增重1.08g和2.64g,试求该有机物的分子式,要求有一定的答题步骤。
某有机物含有C、H、O三种元素,其蒸气密度是相同条件下H2密度的29倍,把1.16g该有机物在O2中充分燃烧,将生成物依次通过足量浓硫酸和碱石灰,浓硫酸增重1.08g,碱石灰增重2.64g,则
(1)该有机物的摩尔质量
(2)该有机物的分子式(写计算过程)
(3)红外光谱和核磁共振氢谱显示该分子是有一个羟基,无甲基的链状结构,请写出其结构简式。
某有机物的相对分子质量为60,1 mol该有机物完全燃烧,生成36 g H2O和44.8 L CO2(标准状况下)。
(1)求分子式
(2)又知此有机物具有弱酸性,能与金属钠反应,也能与碱溶液反应,试写出它可能的结构简式。
取3.40g只含羟基,不含其他官能团的液态饱和多元醇,置于5.00L氧气中,经点燃,醇完全燃烧,反应后气体体积减少0.56L,将气体经CaO吸收,体积又减少2.80L(所有气体体积均在标准状况下测定)。
(1)3.40g醇中C、H、O物质的量分别为:C________mol,H________mol,O________mol,该醇中C、H、O的原子个数比为__________。
(2)由以上比值能否确定该醇的分子式__________(填“能”或“否”)。其原因是____________。
(3)如果将多元醇的任意一个羟基换成一个卤原子,所得到的卤代物都只有1种,写出该饱和多元醇的结构简式_____________________.
苹果酸广泛存在于水果肉中,是一种常用的食品添加剂。物理分析测得苹果酸的相对分子质量为134,存在5种不同环境的H原子,ω(C)=35.82%、ω(H)=4.48%、ω(O)=59.70%。取2.68g苹果酸溶于水配成溶液,用0.80mol/LNaOH溶液滴定耗去50.00mL恰好中和,1mol苹果酸与足量的Na反应生成1.5mol的H2。试求:
(1)苹果酸的分子式;
(2)苹果酸分子中含羧基的个数;
(3)请写出苹果酸的结构简式。
某混合气体由一种气态烷烃和一种气态烯烃组成,在同温同压下,混合气体对氢气的相对密度为13,在标准状况下,将44.8L混合气体通入足量溴水,溴水质量增重28.0g,通过计算回答:
(1)混合气体中气态烷烃的化学式;
(2)混合气体中两种气体的物质的量之比;
(3)写出混合气体中气态烯烃可能的结构简式 ;
(4)若该烯烃被酸性高锰酸钾氧化后可得CO2和丙酮,则该烯烃的名称为?
M是一种新型可生物降解的高分子材料,主要制造可降解纤维、塑料和医用材料,其水解最终产物为N。燃烧9.0g的N只产生CO2和H2O,且质量分别为13.2g和5.4g,实验测得N在标准状况下的蒸气密度为4.02g/L;N的核磁共振氢谱显示的峰面积之比为1︰1︰1︰3。
(1)通过计算确定N的分子式。
(2)写出由N在催化剂条件下缩聚反应合成M的化学方程式。
乙烯与乙烷混合气体共a mol,与b mol的氧气共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO到CO2的混合气体和45g水。试求:
(1)当a=1时,乙烯和乙烷的物质的量之比n(C2H4):n(C2H6)= 。
(2)当a=1,且反应后CO和CO2混合气体的物质的量为反应前氧气的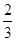 时,则b= ,得到的CO和CO2的物质的量之比n(CO):n(CO2)= 。
时,则b= ,得到的CO和CO2的物质的量之比n(CO):n(CO2)= 。
(3)a的取值范围是 。
5.8g有机物完全燃烧,只生成CO2和H2O蒸气,其体积比为1:1(同压同温),若把它们通过碱石灰,碱石灰增加18.6g,同量的有机物与0.1mol乙酸完全发生酯化反应.又知该有机物对空气的相对密度为2。(简要写出求算过程)
求:(1)有机物的相对分子质量;
(2)有机物的分子式;
(3)有机物的结构简式 。
某有机物,它的相对分子质量为60。 6.0g该有机物完全燃烧后的产物通过浓硫酸后增重7.2g,通过足量澄清石灰水后有30g白色沉淀生成。求:
(1)该有机物的分子式;
(2)写出能与钠反应的该有机物的所有同分异构体的结构简式。
工业上目前使用两种方法制取乙醛:(1)乙炔水化法;(2)乙烯氧化法。下列两表提供生产过程中原料、反应条件、原料平衡转化率、产量等有关的信息情况:
表一:原料、反应条件、平衡转化率、日产量
| |
乙炔水化法 |
乙烯氧化法 |
| 原料 |
乙炔、水 |
乙烯、空气 |
| 反应条件 |
HgSO4、100~125℃ |
PdCl2-CuCl2、100~125℃ |
| 平衡转化率 |
乙炔平衡转化率90%左右 |
乙烯平衡转化率80%左右 |
| 日产量 |
2.5吨(某设备条件下) |
3.6吨(相同设备条件下) |
表二:原料来源生产工艺
| |
原料生产工艺过程 |
| 乙炔 |
 |
| 乙烯 |
来源于石油裂解气 |
根据上述两表,回答下列问题:
(1)写出下列化学方程式:
a.乙炔水化法制乙醛__________________________________________________。
b.乙烯氧化法制乙醛______________________________________________。
(2)从两表中分析,现代工业上乙烯氧化法逐步取代乙炔水化法(从环境、原料来源、产率和产量、能耗等角度),分析可能的原因:________________________________。
(3)从化学反应速率角度分析,在相同条件下,两种制取乙醛的方法哪种快?
___________________________________________________________________。
(4)若将上述两种方法的反应条件,均增加“100atm”,原料平衡转化率_______(填增大、减小、不变);而实际生产中不采用的理由是_____________________________。
(5)若乙烯由石油裂化(裂化气混合气体的平均化学式CnHm、m>2n),进一步完全催化裂解而来,得到体积百分含量分别为:甲烷:5%、乙烯:40%、丙烯:10%、其余为丁二烯和氢气(气体体积均在同温同压下测定)。若得到40mol乙烯,求:能够得到丁二烯和氢气的物质的量各为多少?
试题篮
()