某两种气态烃的1 L混合气体,完全燃烧生成1.4 L CO2和2.0 L水蒸气(体积均在相同状况下测得),该混合物可能是
| A.乙烷、乙烯 | B.甲烷、乙烯 | C.甲烷、丙烯 | D.乙烷、丙烯 |
有关下列物质分子结构特征描述正确的是
| A.乙烯容易与溴的四氯化碳溶液发生反应,且1mol乙烯完全加成消耗1mol溴单质,证明乙烯分子里含有一个碳碳双键 |
| B.苯分子的结构中存在碳碳单键和碳碳双键交替出现的结构 |
C.和 属于同一种物质,不能用来解释甲烷是一种正四面体结构 属于同一种物质,不能用来解释甲烷是一种正四面体结构 |
| D.1mol CH3CH2OH与Na完全反应只生成0.5 mol H2,不能说明乙醇分子中有一个氢原子与其它氢原子不同 |
已知:A是石油裂解气的主要产物之一,其产量常用于衡量一个石油化工发展水平的标志。下列是有机物A~G之间的转化关系:
请回答下列问题:
(1)A的官能团的名称是________________;C的结构简式是________________;
(2)E是一种具有香味的液体,由B + D→的反应方程式为:__________,该反应类型是____________;
(3)G是一种高分子化合物,其结构简式是______________;
(4)比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射物质F(沸点12.27OC)进行应急处理。写出由A制F的化学反应方程式:___________________,决定F能用于冷冻麻醉应急处理的性质是___________________。
已知烯烃在酸性KMnO4溶液中双键断裂形式为:

 现有二烯烃C10H18与酸性KMnO4溶液作用后可得到三种有机物:(CH3)2CO、CH3COOH、CH3CO(CH2)2﹣COOH,由此推断此二烯可能的结构简式为
现有二烯烃C10H18与酸性KMnO4溶液作用后可得到三种有机物:(CH3)2CO、CH3COOH、CH3CO(CH2)2﹣COOH,由此推断此二烯可能的结构简式为
| A.(CH3)2C=C(CH3)CH2CH2CH=CHCH2CH3 |
| B.(CH3)2C=CHCH2CH2C(CH3)=CHCH3 |
| C.CH3CH=C(CH3)CH2CH2CH2C(CH3)=CH2 |
| D.CH3CH=C(CH3)CH2CH2CH2CH=CHCH3 |
氯气和氯乙烯都是非常重要的化工产品,年产量均在107t左右,氯气的实验室制备和氯乙烯的工业生产都有多种不同方法。
完成下列填空:
(1)实验室制取纯净的氯气,除了二氧化锰、浓盐酸和浓硫酸,还需要 、 (填写试剂或溶液名称)
(2)实验室用2.00mol/L盐酸和漂粉精【成分为Ca(ClO)2、CaCl2】反应生产氯气、氯化钙和水,若产生2.24L(标准状况)氯气,发生反应的盐酸盐为 mL。
(3)实验室通常用向上排空气法收集氯气。设计一个简单实验,验证所收集的氯气中是否含有空气。
(4)工业上用电石-乙炔生产氯乙烯的反应如下:CaO+3C CaC2+CO
CaC2+CO
CaC2+2H2O CH≡CH+Ca(OH)2
CH≡CH+Ca(OH)2
CH≡CH+HCl  CH2=CHCl
CH2=CHCl
电石-乙炔法的优点是流程简单,产品纯度高,而且不依赖与石油资源。
电石-乙炔法的缺点是: 、 。
(5)乙烷和氯气反应可制得ClCH2CH2Cl,ClCH2CH2Cl加热分解得到氯乙烯和氯化氢。
设计一种以乙烯和氯气为原料制取氯乙烯的方案(其他原料自选),用化学方程式表示(不必注明反应条件)。
要求:①反应产生的氯化氢必须用于氯乙烯的制备;②不再产生其他废液。
已知:A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平。E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。
(1)A的结构式为__________,C的名称为__________。
(2)B分子中的官能团名称是_______,请设计一种验证B物质存在该官能团的方法__________。
(3)写出下列反应的化学方程式并指出反应类型:
①__________________________________________;反应类型是_____________;
④__________________________________________;反应类型是_____________。
通过石油裂化和裂解可以得到乙烯、丙烯、甲烷等重要化工基本原料。目前,仅有10%产量的石油转化为化工、医药等行业的基本原料加以利用。用石油裂化和裂解过程得到的乙烯、丙烯来合成丙烯酸乙酯的路线如下:
已知:CH3CHO CH3COOH
CH3COOH
根据以上材料和你所学的化学知识回答下列问题:
(1)由CH2=CH2制得有机物A的化学反应方程式是 ,反应类型是 。
(2)有机物B中含有的官能团为 、 (填名称)。
(3)写出A与B合成丙烯酸乙酯的反应方程式是 ,反应类型是 。其中浓硫酸所起的作用是 。
(4)在沙漠中,喷洒一定量的聚丙烯酸乙酯,能在地表下30~50厘米处形成一个厚0.5厘米的隔水层,既能阻断地下盐分上升,又有拦截蓄积雨水的作用,可使沙漠变成绿洲。写出丙烯酸乙酯在引发剂作用下聚合成聚丙烯酸乙酯的化学方程式 ,反应类型是 。
研究物质的合成或制备是有机化学、无机化学的重要任务之一。
(1)某实验小组探究实验室制备无水氯化镁的方法,设计了以下装置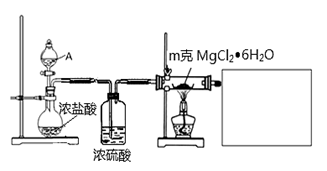
①分液漏斗中的A物质是________________(填试剂名称)。
②利用中学常见的仪器,在答题卡中补充完整实验装置(不必画出夹持装置)。可选择的试剂有:稀NaOH溶液、无水氯化钙、稀硫酸、浓硫酸。
③假设实验过程中MgCl2▪6H2O未水解,不用任何试剂用最简单的方法检验MgCl2▪6H2O是否完全转化为MgCl2。写出实验方法________________
④工业生产中得到无水氯化镁可用于电解制备镁单质,电解装置中,镁在____极析出。
(2)实验室制备并收集纯净乙烯
①有的同学通过乙醇发生消去反应进行实验。除乙醇外,所需的试剂或用品(不包括仪器)有_________________。
②有的同学探究其它制备乙烯的方法,他设计了以下装置制备乙烯。实验结果是量筒内壁附着较多无色油状液体,且得到很少量的气体,请分析气体产率很低的原因主要是________________________。为增大气体产率,在右图装置的基础上,提出一点改进措施:__________________。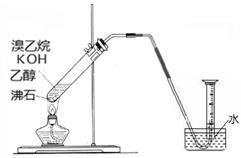
从实验安全角度考虑,该实验很可能发生的问题是____________________________。
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:


可能用到的有关数据如下:
| |
相对分子质量 |
密度/(g·cm-3) |
沸点/℃ |
溶解性 |
| 环己醇 |
100 |
0.961 8 |
161 |
微溶于水 |
| 环己烯 |
82 |
0.810 2 |
83 |
难溶于水 |
合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是_______________。
(2)加入碎瓷片的作用是________________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填正确答案标号)。
A.立即补加 B.冷却后补加
C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为______________。
(4)分液漏斗在使用前须清洗干净并________;在本实验分离过程中,产物应该从分液漏斗的________(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是_______________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________(填正确答案标号)。
A.圆底烧瓶
B.温度计
C.吸滤瓶
D.球形冷凝管
E.接收器
(7)本实验所得到的环己烯产率是____________(填正确答案标号)。
A.41% B.50% C.61% D.70%
I.乙烯与乙烷的混合气体共a mol,与b mol氧气共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO和CO2的混合气体和45 g水。试求:
(1)当a=1时,乙烯和乙烷的物质的量之比n(C2H4)∶n(C2H6)=________。
(2)当a=1,且反应后CO和CO2的混合气体的物质的量为反应前氧气的 时,b=________,得到的CO和CO2的物质的量之比n(CO)∶n(CO2)=________。
时,b=________,得到的CO和CO2的物质的量之比n(CO)∶n(CO2)=________。
II科学家于1978年制得一种物质A,A可看作是烃B的所有氢原子被烃C的一价基取代而得。A遇Br2的CCl4溶液不褪色。A中氢原子被1个氯原子取代只得一种物质。一定量的C完全燃烧所得的H2O和CO2的物质的量之比为1.25:1。C的同分异构体不超过3种,而C的二溴代物为3种。一定量的B完全燃烧生成的CO2和H2O的物质的量之比为2。B的相对分子质量大于26,小于78。试回答下列问题:
(1)B的分子式为 。
(2)写出C的3种二溴代物的结构简式: 、 、 。
(3)A的分子式为 ;A的结构简式为 。
已知烯烃经臭氧氧化后,在Zn存在下水解,可得到醛和一种有机物酮。如:
现有化学式C7H14的某烯烃,它与H2加成后生成2,3–二甲基戊烷,它经臭氧氧化后在Zn存在下水解成乙醛和一种酮,据此推知该烯烃的结构简式为:
A. |
B. |
C. |
D. |
(6分)由一种气态烷烃和一种气态单烯烃组成的混合气体,它对H2的相对密度是13.2,将1L的混合气体和4LO2在容积固定的密闭容器中完全燃烧并保持原来的温度(120℃),测得密闭容器内压强比反应前增加了4%,试确定混合气体的成分及体积比。
仔细体会下列有机合成过程中碳骨架的构建及官能团引入和转化,完成下题:
已知两个醛分子在NaOH溶液作用下可以发生加成反应,生成一种羟基醛:
肉桂醛F(分子式为C9H8O)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的: .
.
已知:反应⑤为羟醛缩合反应。请回答:
(1)肉桂醛F的结构简式为: 。E中含氧官能团的名称为 。
(2)反应①~⑥中符合绿色化学思想的是 。
(3)写出下列转化的化学方程式:
② ;
⑤ 。
写出有关反应的类型:③ ;⑥ 。
(4)符合下列要求的E物质的同分异构体有 种(苯环上有两个取代基,其中有一个甲基在对位,且属于酯类)。
乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答:
(1)乙烯的电子式为 ,结构简式为________________。
(2)下列可以鉴别甲烷和乙烯的试剂为________(填选项字母)。
A.稀硫酸 B.溴的四氯化碳溶液
C.水 D.酸性高锰酸钾溶液
(3)下列物质中,不能通过乙烯加成反应得到的是________(填选项字母)。
A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
(4)2CH3CHO + O2 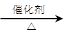 2CH3COOH 以乙烯为主要原料合成乙酸,合成线路如下图所示:
2CH3COOH 以乙烯为主要原料合成乙酸,合成线路如下图所示: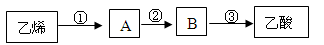
反应③的反应类型为 反应,反应②的化学方程式为 。
工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,该反应类型为 反应,其反应的化学方程式为 。
I .含碳原子数最少且存在同分异构体的烷烃的分子式是_____,其同分异构体的结构简式是________。
II.从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78。回答下列问题:
(1)A的电子式_______,B的结构简式______。
(2)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式:_______,反应类型:________。
(3)在碘水中加入B振荡静置后的现象________________。
(4)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式:_________,反应类型:________。
(5)等质量的A、B完全燃烧时消耗O2的物质的量________(填A>B、A<B或A=B”)。
III.已知乙烯能发生以下转化: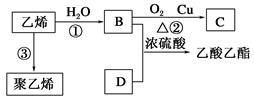
(1)C中含官能团名称_________;
(2)写出反应的化学方程式及反应类型:
B与D反应的化学方程式__________________;反应类型:________。
试题篮
()