下列关于化学键的说法正确的是
| A.离子化合物中一定存在离子键,可能存在共价键 |
| B.由金属元素和非金属元素组成的化学键一定是离子键 |
| C.非极性键只存在于双原子单质分子中 |
| D.NH4Cl是一种共价化合物 |
下列粒子属等电子体的是
| A.NO和O2 | B.CH4和NH4+ | C.NH2¯和H2O2 | D.HCl和H2O |
下列说法正确的是
| A.含有离子键和共价键的化合物一定是离子化合物 |
| B.元素原子的最外层电子数等于该元素的最高正化合价 |
| C.目前人们已发现的元素种类数目与原子种类数目相同 |
| D.多电子原子中,在离核较近的区域内运动的电子能量较高 |
下列排列顺序不正确的是
| A.热稳定性:HF>H2O>NH3 | B.原子半径:Cl>S>P |
| C.碱性:NaOH>Mg(OH)2>Al(OH)3 | D.金属性:K>Na>Li |
下列有关晶体的说法中正确的是
| A.氯化钾溶于水时离子键未被破坏 |
| B.原子晶体中共价键越强,熔点越高 |
| C.冰融化时分子中共价键发生断裂 |
| D.分子间作用力越大,分子越稳定 |
下列有关判断化学基本概念的依据中,一定正确的是
| A.离子晶体:由阴阳离子构成的晶体 |
| B.共价化合物:含有共价键的化合物 |
| C.酸性:PH<7 |
| D.强电解质:能溶于水的化合物 |
下列说法正确的是
| A.含极性键的分子一定是极性分子 |
| B.键能越小,表示该分子受热越难分解 |
| C.在分子中,两个成键原子间的距离叫做键长 |
| D.H-Cl的键能为431.8kJ/mol,H-I的键能为298.7kJ/mol,说明HCl分子比HI分子稳定 |
a为乙二胺四乙酸(EDTA),易与金属离子形成螯合物。b为EDTA与Ca2+形成的螯合物。下列叙述正确的是( )

A.a和b中的N原子均为sp3杂化
B.b中Ca2+的配位数为4
C.b含有分子内氢键
D.b含有共价键、离子键和配位键
下列每组分子主要能形成分子间氢键的是( )
| A.HClO4 和 H2SO4 | B.CH3COOH和H2Se |
| C.C2H5OH和NaOH | D.H2O2和HNO3 |
氯化硼的熔点为-107℃、沸点为12.5℃,在氯化硼分子中,氯—硼—氯键角为120º,它可以水解,水解产物之一是氯化氢,下列对氯化硼的叙述中正确的是
| A.氯化硼是原子晶体 |
| B.熔化时,氯化硼能导电 |
| C.硼原子以sp3杂化 |
D.水解方程式:BCl3+3H2O H3BO3+3HCl H3BO3+3HCl |
下列有关硫元素及其化合物的表示正确的是
A.中子数为18的硫原子: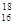 S S |
B.CS2分子的电子式: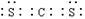 |
C.硫离子(S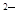 )的结构示意图: )的结构示意图: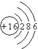 |
D.苯磺酸的结构简式: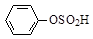 |
试题篮
()