我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大。元素A、B、C、D、E的原子结构等信息如下:
元素 元素性质或原子结构
A 周期表中原子半径最小的元素
B 原子核外有三种不同的能级且各个能级所填充的电子数相同
C 最外层p轨道半充满
D 位于短周期,其原子的核外成对电子数是未成对电子数的3倍
E 位于ds区且原子的最外层电子数与A的相同
请回答下列问题(用A、B、C、D、E所对应的元素符号作答):
(1)B、C、D第一电离能由小到大为______________。
(2)E的二价离子的电子排布式为______________。
(3)A2B2D4常用作除锈剂,该分子中B的杂化方式为_______________;1 mol A2B2D4分子中含有σ键数目为____________。
(4)与化合物BD互为等电子体的阴离子化学式为________________(任写一种)。
(5)B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是__________________。
(6)BD2在高温高压下所形成晶体的晶胞如图所示。一个该晶胞中含______________个D原子。

I 含碳原子数最少且存在同分异构体的烷烃的分子式是_____,其同分异构体的结构简式是________。
II从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78。回答下列问题:
(1)A的电子式_______,B的结构简式_______。
(2)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式:___________,反应类型:_______。
(3)在碘水中加入B振荡静置后的现象________________。
(4)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式:_____________,反应类型:________。
(5)等质量的A、B完全燃烧时消耗O2的物质的量________(填A>B、A<B或A=B”)。
III已知乙烯能发生以下转化:
(1)C中含官能团名称_________;
(2)写出反应的化学方程式及反应类型:
B与D反应的化学方程式__________________;反应类型:________。
有四种化合物W、X、Y、Z,它们都是由短周期元素A、B、C、D、E中的两种元素组成的。已知:
(a)A、B、C、D、E五种元素的原子序数依次增大,且A、D同主族,C、E同主族,B、C同周期。
(b)W由B、C组成,分子中原子个数比为B:C=1:2,固体易升华。
(c)X由A、C组成,分子中原子个数比为A:C=1:1。
(d)Y由C、D形成的离子化合物,且Y中相应元素的微粒之比为:C:D=1:1。
(e)Z是由D、E形成的离子化合物,其中阳离子比阴离子少一个电子层,阴、阳离子数之比为1:2。
试回答下列各小题:
(1)各元素符号:A B C D E
(2)W的电子式: 。
(3)X的结构式: 。
(4)Y的电子式: 。
(5)Z的化学式: 。
(6)写出Y与水反应的化学方程式: 。
I.A、B、C、D、E、F为常见的原子序数依次增大的短周期元素,B、C、D、E、F的简单离子的电子层结构相同,A和E同主族,且原子的最外层电子数的关系为A+D=B+F=8。请回答:
(1)试写出B2单质的电子式:________。试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式 。
(2)含F元素对应的金属阳离子的溶液中滴加过量E的最高价氧化物对应水化物的溶液,其离子方程式是________________。
(3)已知B2A4与BA3具有相似的性质,B2A4通过炽热的氧化铜粉末,粉末由黑色变为红色,且产物对大气无污染,其化学反应方程式是________________。
(4)在2 L的密闭容器中,通入2 mol B2气体和3 mol A2气体,一定温度下反应生成BA3 气体,当反应达到平衡时,A2的浓度为0.15 mol·L-1,同时放出约83.2 kJ的热量,该反应的热化学方程式为_____________。
(5)已知某化合物EB3与水可以反应生成两种气体单质和一种碱,试写出其化学方程式 ___________;若0.1 mol该化合物完全反应,转移电子的物质的量为________。
II.(1)甲、乙是元素周期表中同一主族相邻周期的两种元素(其中甲在上一周期),若甲的原子序数为x,则乙的原子序数可能是________。
(2)若甲、乙分别是同一周期的ⅡA族和ⅦA族元素,原子序数分别为m和n,则m和n的关系为________。
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A原子核内无中子;B元素的最高价氧化物对应水化物与其氢化物能反应生成盐F;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。请回答下列问题:
(1)C元素在元素周期表中的位置是 ;C、D、E三种元素简单离子半径由大到小的顺序为 (用离子符号表示)。
(2)写出分别由A、D与C形成的原子个数比为1:1的化合物的电子式 、 。
(3)A与C、E间分别形成甲、乙两种共价化合物,且甲有10个电子,乙有18个电子,则沸点较高的是(填化学式) 。
(4)F含有的化学键类型是 、 。
(5)D和C形成的一种化合物能与A和C形成的一种化合物反应产生C单质,该反应的离子方程式为 。
(6)用电子式表示A、B形成化合物的过程: 。
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且原子的最外层电子数之和为15;X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2 。下列说法正确的是
| A.原子半径:W>Z>Y>X>M |
| B.XZ2、X2M4均为直线形的共价化合物 |
| C.W2Z2是既含离子键又含共价键的离子化合物 |
| D.由X、Y、Z、M四种元素形成的化合物一定既有离子键、又有共价键 |
下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
|
|
|
① |
② |
③ |
|
|
| 3 |
④ |
|
⑤ |
|
|
⑥ |
⑦ |
⑧ |
| 4 |
⑨ |
|
|
|
|
|
|
|
(1) 在这些元素中,化学性质最不活泼的是:_____________ (填具体元素符号,下同)。
(2) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______,碱性最强的化合物的电子式是:_____________。
(3) 最高价氧化物是两性氧化物的元素是___________;写出它的氧化物与氢氧化钠反应的离子方程式________________________。
(4) 用电子式表示元素④与⑥形成的的化合物的形成过程______________________ ,该化合物属于__________________(填 “共价”或“离子”)化合物。
(5)元素①与⑦形成的的化合物的电子式为__________________,该化合物是由___________ (填“极性”“非极性”)键形成的。
乙烯是来自石油的重要有机化工原料,其产量通常用来衡量一个国家的石油化工发展水平。结合以下路线回答: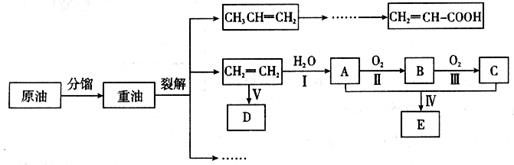
已知:
(1)写出A的电子式 。
(2)反应II的化学方程式是__________。
(3)D为高分子化合物,可以用来制造多种包装材料,其结构简式是__________。
(4)E是有香味的物质,在实验室用下图装置制取。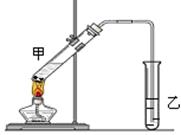
①反应IV的化学方程式是__________,该反应类型为______。
②该装置图中有一个明显的错误是 。
(5)为了证明浓硫酸在反应IV中起到了催化剂和吸水剂的作用,某同学利用上图改进后装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管乙再测有机层的厚度,实验记录如下:
| 实验编号 |
试管甲中试剂 |
试管乙中试剂 |
有机层的厚度/cm |
| A |
2 mL乙醇、1 mL乙酸、 1mL18mol·L-1浓硫酸 |
饱和Na2CO3溶液 |
3.0 |
| B |
2 mL乙醇、1 mL乙酸 |
0.1 |
|
| C |
2 mL乙醇、1 mL乙酸、 3 mL 2mol·L-1 H2SO4 |
0.6 |
|
| D |
2 mL乙醇、1 mL乙酸、盐酸 |
0.6 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是3mL和_____mol·L-1。
②分析实验 (填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
下表是元素周期表一部分,列出了九种元素在周期表中的位置:
| 族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 2 |
|
|
|
⑤ |
⑥ |
⑦ |
⑧ |
|
| 3 |
① |
③ |
④ |
|
|
|
⑨ |
|
| 4 |
② |
|
|
|
|
|
|
|
请用化学用语回答下列问题
(1)在上述元素中,金属性最强的是 ,在③~⑦元素中,原子半径最大的是 ;
(2)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是 (填物质化学式)。写出①和④的最高价氧化物对应的水化物反应的离子方程式 。
(3)用电子式表示③和⑨形成的化合物的形成过程 。
(4)表中元素①和⑦可以形成一种淡黄色物质X,写出X的电子式: ,该物质所含化学键类型 ,0.1mol X与水反应转移电子数为: 。
(5)表中元素⑥和⑧可形成一种相对分子量为66的共价化合物Y,Y分子中各原子均达到“8电子稳定结构”,Y的结构式 。
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 |
IA |
|
0 |
|||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
|
|
|
② |
③ |
④ |
|
|
| 3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)⑧的原子结构示意图为_________。
(2)②的气态氢化物分子的结构式为_______,②和⑦的气态氢化物的稳定性相比,其中较弱的是____(用该氢化物的化学式表示)。
(3)②、③的最高价含氧酸的酸性由强到弱的顺序是 (填化学式)。
(4)⑤、⑥元素的金属性强弱依次为___________(填“增大”、“减小”或“不变”)。
(5)④、⑤、⑥的形成的简单离子半径依次_________(填“增大”、“减小”或“不变”)。
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式: ,形成的晶体是 晶体。
A、B、C、D、E、F六种短周期主族元素,其原子序数依次增大,其中B与C同周期,D与E 和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)元素F在周期表中的位置________。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)________。
(3)由A、B、C三种元素以原子个数比4:2:3形成化合物X,X中所含化学键类型有______。检验该化合物中的阳离子的方法是________(用离子方程式表示)。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出D元素的最高价氧化物对应的水化物与E的最高价氧化物反应的离子方程式:________________________。若E是非金属元素,其单质在电子工业中有重要应用,请写出其单质溶于强碱溶液的离子方程式:_______________。
下表列出了①~⑨九种元素在周期表中的位置。请回答(用化学用语):
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
|
|
|
⑤ |
|
⑥ |
|
|
| 3 |
① |
③ |
④ |
|
|
|
⑦ |
⑨ |
| 4 |
② |
|
|
|
|
|
⑧ |
|
(1)在这些元素中,最活泼的金属元素是 ;最活泼非金属元素是 ;最不活泼的元素是 。
(2)这些元素的最高价氧化物对应的水化物中,酸性最强的化合物的分子式是 ;碱性最强的化合物的电子式 ;能形成两性氢氧化物的元素是 。
(3)①、②、③三种元素的原子半径由大到小的顺序依次为 。
(4)⑥元素的氢化物是 ,该氢化物在常温下与②发生反应的化学方程式为 ,所得溶液的PH 7.
(5)用电子式表示 ①和⑧元素形成化合物的过程 。
I.下列是中学化学中熟悉的物质,请用序号完成下列问题
①O2 ②Na2O2 ③NH4Cl ④HCl ⑤NaOH ⑥CaCl2
(1)这些物质中,只含共价键的是 。
(2)只含离子键的是 。
(3)既含共价键又含离子键的是 。
(4)属于离子化合物的是 ,属于共价化合物的是 。
II.(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是 。(填“吸热”或“放热”)反应,NO2和CO的总能量 (填“大于”、“小于”或“等于”)CO2和NO的总能量。
(2)下列反应中,属于放热反应的是 ,属于吸热反应的是 。
①物质燃烧;
②酸碱中和反应;
③Ba(OH)2·8H2O与NH4Cl反应;
④二氧化碳通过炽热的碳;
⑤铝与四氧化铁在高温条件下的反应
有A、B、C、D、E四种短周期元素,原子序数依次增大,在周期表中B与C相邻、D与E相邻。已知A原子的电子层数与它的核外电子总数相同。B元素的氢化物与E元素的氢化物反应只生成一种盐;C、D位于同一族,它们能组成DC2、DC3两种常见化合物。请回答下列问题:
(1)C是________,D是____________,E是____________(填元素名称)。
(2)由A、B、C中的两种元素组成,且与A2C分子具有相同电子数的两种阳离子是________和________(写化学式)。
(3)D与E可形成共价化合物D2E2,分子中D与E均满足8电子稳定结构,则D2E2的电子式为_______。
(4)A、B、C可以形成一种盐,此盐中A、B、C元素的原子的个数比为4:2:3,该盐的化学式是____________。该盐受热可产生B的单质和B的最高价氧化物的水化物,对应化学方程式是____________。
(5)A、B可以形成一种离子化合物,电子式是____________
下列叙述错误的是:
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③ⅡA族元素的阳离子与上周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤多电子原子中,在离核较近的区域内运动的电子能量较高
⑥已知H2SO4(aq)+2NaOH(aq)=2H2O(l)+Na2SO4(aq) △H= -114.6kJ·mol-1 则中和热为57.3kJ·mol-1
⑦两个非金属元素原子间只可能形成共价键,而含金属元素的化合物中一定含离子键
| A.②④⑥ | B.①⑤⑥ | C.②③④ | D.①⑤⑦ |
试题篮
()