固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子电子层结构。则下列有关说法中错误的是
| A.1 mol NH5中含有5NA个N-H键(NA表示阿伏加德罗常数的值) |
| B.NH5中既有共价键又有离子键 |
C.NH5的电子式为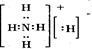 |
| D.它与水反应的化学方程式为NH5+H2O=NH3·H2O+H2↑ |
下列物质中,存在非极性键的化合物的是
| A.NaOH | B.CH4 | C.H2 | D.Na2O2 |
下列每组中各物质内既有离子键又有共价键的一组是( )
| A.NaOH、H2SO4、(NH4)2SO4 | B.MgO、Na2SO4、NH4HCO3 |
| C.Na2O2、KOH、Na2SO4 | D.HCl、Al2O3、MgCl2 |
NH3分子的空间构型是三角锥形,而不是正三角形的平面结构,解释该事实的充分理由是
| A.NH3分子是极性分子 |
| B.分子内3个N—H键的键长相等,键角相等 |
| C.NH3分子内3个N—H键的键长相等,3个键角都等于107° |
| D.NH3分子内3个N—H键的键长相等,3个键角都等于120° |
下列描述正确的是( )
| A.CS2为V形极性分子 |
| B.SiF4与SO32-的中心原子均为sp3杂化 |
| C.C2H2分子中σ键与π键的数目比为1∶2 |
| D.水加热到很高温度都难分解是因水分子间存在氢键 |
以下微粒含配位键的是( )
①N2H5+ ②CH4 ③OH-④NH4+ ⑤Fe(CO)3 ⑥Fe(SCN)3 ⑦H3O+⑧[Ag(NH3)2]OH
| A.①④⑥⑦⑧ | B.③④⑤⑥⑦ | C.①④⑤⑥⑦⑧ | D.全部 |
短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且Y2-与Z+核外电子层的结构相同。下列化合物中同时存在极性和非极性共价键的是( )
| A.Z2Y | B.X2Y2 | C.Z2Y2 | D.ZYX |
下列有关σ键和π键的说法错误的是( )
| A.在某些分子中,化学键可能只有π键而没有σ键 |
| B.当原子形成分子时,首先形成σ键,可能形成π键,配位键都是σ键 |
| C.σ键的特征是轴对称,π键的特征是镜面对称 |
| D.含有π键的分子在反应时,π键是化学反应的积极参与者 |
下列说法中正确的是( )
| A.在分子中,两个成键的原子间的距离叫做键长 |
| B.H—Cl的键能为431.8 kJ·mol-1,H—I的键能为298.7 kJ·mol-1,这可以说明HCl分子比HI分子稳定 |
| C.键长越短,表明共价键越不稳定 |
| D.键能越大,表示形成该化学键时吸收的能量越多 |
氰的分子式为(CN)2,结构式为N≡C-C≡N,性质与卤素相近,下列叙述正确的是
| A.在一定条件下可发生加成反应 |
| B.分子中N≡C键的键长大于C≡C键的键长 |
| C.分子中含有2个σ键和4个π键 |
| D.不和氢氧化钠溶液发生反应 |
试题篮
()