(11分)在Ar、KCl、CO2、SiO2、NaOH等物质中[(1)题填物质的名称]
(1)构成各物质的微粒中,只存在离子键的是____ ;只存在共价键的是______ _;既存在离子键又存在共价键的是_____ ____;不存在化学键的是______ ___。
(2)在上述化合物中,固态时属于原子晶体的是____ ;属于分子晶体的是_____ __属于离子晶体的是____ ____。
(3)KCl的电子式是_______ _,CO2的电子式是____ ____。
在下列物质中:NaOH、Na2S、(NH4)2S、Na2O2、C2H2、SiC晶体。
⑴其中只含有离子键的离子晶体是 ;⑵其中既含有离子键又含有极性共价键的离子晶体是 ;
⑶其中既含有离子键,又含有极性共价键和配位键的离子晶体是 ;
⑷其中既含有离子键又含有非极性共价键的离子晶体是 ;
⑸其中含有极性共价键和非极性共价键的非极性分子是 ;
⑹其中含有极性共价键的原子晶体是 。
(1)下列变化:①碘的升华;②氧气溶于水;③氯化钠溶于水;④烧碱熔化;⑤氯化氢溶于水;⑥氯化铵受热分解。(填序号)
化学键没有被破坏的是 ;仅发 生离子键破坏的是___ 仅发生离子键破坏的是 ;既发生离子键又发生共价键破坏的是 ______。
生离子键破坏的是___ 仅发生离子键破坏的是 ;既发生离子键又发生共价键破坏的是 ______。
(2)已知拆开1 mol H—H键、1 mol N≡N、1 mol N—H键分别需要吸收的能量为436kJ、946k J、391k J。则由N2和H2反应生成1 mol NH3
需要 (填“放出”或“吸收”) 的热量。
(11分) 元素周期表反映了元素性质的周期性变化规律。请根据短周期元素在周期表中的位置、结构和相关性质,回答下列问题:
(7) 第VIA族元素形成的气态氢化物中沸点最高的是____________(用分子式表示),原因是____________________,该分子的空间构型为______________。
(8) 第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如表1所示,其中E的化学式为 ;第三周期元素单质的熔点(℃)变化如图a所示,其中h的元素符号为 。 (表1)
| 氢化物 |
A |
B |
HF |
D |
E |
| 沸点/℃ |
1317 |
100 |
19.5 |
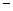 33.35 33.35 |
 164 164 |
(9) 第二、第三周期的某些元素能形成单质甲和化合物乙,它们具有图b所示的结构单元,甲和乙的晶体类型相同,甲的某种同素异形体与乙在高温时能发生置换反应生成h的单质和CO。若该反应生成的h的单质含有1 mol共价键,则参加反应的乙的质量为_______________g。
(10)碳元素的某种单质具有平面层状结构,该单质的名称为__________;同一层中的原子构成许多的正六边形,单质与熔融的钾相互作用,形成某种青铜色的物质(其中的元素钾用“●”表示),原子分布如图c所示,该物质的化学式为 。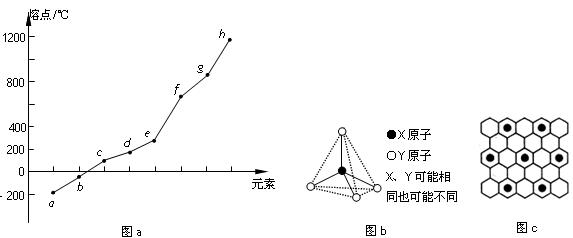
(物质结构与性质)有A、B、C、D、E、F 6种元素,B原子得到一个电子后3p轨道全充满,A+比B形成的简单离子少一个电子层;C原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的;D和E是位于同一主族的短周期元素,E元素的最高化合价和最低化合价的代数和为零,E在其最高价氧化物中的质量分数为46.67%;F元素的核电荷数为26。请回答下列问题:
(1)A元素位于元素周期表中第_________周期第__________族;;F元素基态原子形成的+3价阳离子的电子排布式为___________。
(2)C与B形成的CB3分子中C原子的杂化方式是____________,其分子的空间构型是____________
(3)另一元素X与A同主族,第一电离能小于A,晶体XB与AB中熔点较高的是 _____________,其理由是______________________
(4)1mol ED晶体中含有的E—D键的数目是____________。
在NaCl、NH4Cl、N2、CO2中,只含有离子键的是________(填化学式,下同),只含有极性键的是_________,只含有非极性键的是__________,既含有离子键又含有共价键的是__________。
某共价化合物含 C 、 H 、 N三元素 , 分子内有 4 个 N 原子 , 且 4 个 N 原子排列成内空的四面体 ( 如白磷分子结构 ), 每两个 N 原子间都有一个 C 原子 , 分子内无C-C单键和C=C双键。
(1) 试确定该化合物的分子式_____________
(2) 假若某大分子 , 分子内只含 C 、 H 、 P 二种元素 , 其最小的重复的结构单元如上图当该化合物分子中含n个磷原子时,则该化合物的组成可表示为____________________。
用下列:①H2O ②H2O2 ③Ba(OH)2 ④Na2O2 ⑤Cl2 ⑥Ar ⑦CO2 等物质填空。(填序号)
(1) 由离子键和非极性键构成的是
(2) 由极性键和非极性键构成的是
(3) 不存在化学键的是
(4) 共价化合物有
(5) 含有极性共价键的离子化合物的是
有下列一组物质:He、Cl2、CH4、Na2O2、Ba(OH)2、NO2、KNO3、H2SO4,请从中选择,用化学式填写下列空白:
(1)只含有共价键,不含其他化学键的化合物有 ;
(2)既含有共价键又含有离子键的物质有 ;
(3)能在水中发生氧化还原反应的有 。
下列五种物质中,①Ar ②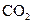 ③
③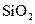 ④NaOH ⑤CaCl2
④NaOH ⑤CaCl2
只存在共价键的是 (填序号),只存在离子键的是 ,既存在离子键又
存在共价键的是 ,不存在化学键的是 。属于共价化合物的是 ,
属于离子化合物的是 。
氮元素可形成丰富多彩的物质。
(1)基态氮原子的价电子轨道表示式为______________;等物质的量的NH3和N2混合气体中σ键与π键的数目之比为___________________。
(2)光化学烟雾易在PM2.5尘粒的催化作用下形成,光化学烟雾中含有NOx、O3、CH2=CHCHO、HCOOH等二次污染物。下列说法正确的是__________________。
| A.N2O与CO2互为等电子体,其结构式为N=N=O |
| B.O3的沸点大于O2 |
| C.CH2=CHCHO分子中碳原子的杂化方式为sp2、sp3 |
| D.HCOOH在水中溶解度大的原因与氢键有关 |
(3)在配合物中,下列微粒NH3、NH4+、NH2OH不能作为配位体的有____________。
(4)图a为六方氮化硼晶体结构示意图,该晶体中存在的作用力有______________。


(5)六方氮化硼在高温高压下可转化为立方氮化硼,其晶胞结构如图b,晶胞边长为dcm,该晶胞中含有_________个氮原子、__________个硼原子,立方氮化硼的密度是__________g·cm-3(阿伏伽德罗常数的值为NA)
(12分)阅读以下信息,并回答问题
数十亿年来,地球上的物质不断地变化。大气的成分也发生了很大的变化。下表是原始大气和目前空气的主要成分:
用上表所涉及的分子填写下列空白:
(1)由极性键构成的非极性分子有________和__________(填写化学式)。
(2)极易溶于水、其水溶液呈碱性的物质的分子是_________(填写化学式),它之所以极易溶于水,是因为它的分子和水分子之间可形成_______键。
(3)分子中不含孤对电子的分子(除稀有气体外)为__________(填写化学式),它的立体构型为____________。
(4)CO的结构可表示为 ,与CO结构最相似的分子是________(填写化学式),这两种结构相似的分子中,分子的极性________(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个不同,它叫________键。
,与CO结构最相似的分子是________(填写化学式),这两种结构相似的分子中,分子的极性________(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个不同,它叫________键。
(5)随着原始大气中O2的缓慢增加,CH4、NH3、CO等气体逐渐被氧气氧化而缓慢地减少,使大气的成分逐渐演化成目前空气。原始大气中NH3可转化为目前空气中的__________(填化学式)。下
(6)人工模拟是当前研究的热点。有研究表明,化合物X可用于研究模拟酶,当其结合或Cu(I)(I表示化合价为+1)时,分别形成a和b:下
分析a和b中微粒间的相互作用(包括化学键和分子间相互作用),试指出其不同点:
a中含 ,b中含 。(用“氢键”、“配位键”、“极性键”、“非极性键”等填空)
在HF、H2O、NH3、CH4、N2、CO2、HI分子中:
(1)以非极性键结合的非极性分子是 。
(2)以极性键相结合,具有正四面体结构的非极性分子是 。
(3)以极性键相结合,具有三角锥型结构的极性分子是 。
(4)以极性键相结合,具有v型结构的极性分子是 。
(5)以极性键相结合,而且分子极性最大的是 。
(共6分)以下物质①HF②H2③H2O④N2⑤C2H4⑥H2O2⑦NaCl(填序号)
(1)只含有极性键的是 ;
(2)既含有极性键又含有非极性键的是 ;
(3)属于极性分子的是 ;
(4)既有σ键又有π键的是 ;
(5)含有s—sσ键的是 ;
(6)以上物质为固体时,属于离子晶体的是 。
A、B、C、D四种短周期元素原子序数依次增大,A元素原子的价电子排列为ns2np2,B元素的最外层电子数是其电子层数的3倍,E元素原子的价电子排布为3d64s2。C、D的电离能数据如下(kJ·mol―1):
| |
I1 |
I2 |
I3 |
I4 |
| C |
738 |
1451 |
7733 |
10540 |
| D |
577 |
1817 |
2745 |
11578 |
(1)化合价是元素的一种性质。由C、D的电离能数据判断,C通常显 价,D显 价;
(2)某单质甲分子与化合物AB分子中电子总数相等,则甲分子中包含___个σ键,___个π键;
(3)AB的总键能大于甲的总键能,但AB比甲容易参加化学反应。根据下表数据,说明AB比甲活泼的原因是______________________________
| |
单键 |
双键 |
叁键 |
|
| AB |
键能(kJ·mol―1) |
357.7 |
798.9 |
1071.9 |
| 甲 |
键能(kJ·mol―1) |
154.8 |
418.4 |
941.7 |
(4)E能与AB形成配合物,其中E提供______________,AB提供________________。
(5)下列晶胞中,阳离子与阴离子的个数为 
试题篮
()