在1×105Pa和298K时,将拆开1mol共价键 所需要的能量称为键能(kJ·mol-1)。下面是一些共价键的键能:
所需要的能量称为键能(kJ·mol-1)。下面是一些共价键的键能:
| 共价键 |
H-H |
N≡N |
N-H |
| 键能(kJ·mol-1) |
436 |
945 |
391 |
(1)根据上表中的数据判断工业合成氨的反应:N2+3H2 2NH3是___________(填“吸热”或“放热”)反应;
2NH3是___________(填“吸热”或“放热”)反应;
(2)在298K时,取1mol氮气和3mol氢气放入一密闭容器中,在催化剂存在下进行反 应,若氮气和氢气完全反应,理论上放出或吸收的热量为Q1,则Q1为__________;
应,若氮气和氢气完全反应,理论上放出或吸收的热量为Q1,则Q1为__________;
(3)实际生产中,放出或吸收的热量为Q2,Q1与Q2比较,正确的是 ( )
A. Q1>Q2 B. Q1<Q 2 C. Q1=Q2
2 C. Q1=Q2
如此选择的理由_________________________________________________;
⑷.哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充人1mol N2和3mol H2,在一定条件下使该反应发生:N2+3H2 2NH3。下列有关说法正确的是_______________________.
2NH3。下列有关说法正确的是_______________________.
A.达 到化学平衡时,正反应和逆反应的速率都为零。
到化学平衡时,正反应和逆反应的速率都为零。
B.当符合:3u正(N2)=u正(H2)时,反应达到平衡状态。
C.达到化学平衡时,单位时间消耗amolN2,同时生成3amolH2
D. k反应达到平衡状态,最多可生成氨2 mol。
E. 工业 合成氨,我们希望提高反应物的转化率并加快反应速率。
合成氨,我们希望提高反应物的转化率并加快反应速率。
F.氨分子内形成氢键,使氨的沸点升高.
G.氮分子的分子间作用力大,使氮分子化学性质很稳定.
H.氢能源属于化石能源.
已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出13种元素的X的数值:
| 元素 |
Al |
B |
Be |
C |
Cl |
F |
Li |
| X数值 |
1.5 |
2.0 |
1.5 |
2.5 |
2.8 |
4.0 |
1.0 |
| 元素 |
Mg |
Na |
O |
P |
S |
Si |
|
| X数值 |
1.2 |
0.9 |
3.5 |
2.1 |
2.5 |
1.7 |
|
试结合元素周期律知识完成下列问题:
(1)经验规律:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AIBr3中的化学键类型是 。
(2)根据上表给出的数据,简述主族元素的X的数值大小与元素的金属性或非金属性强弱之间的关系 。
简述第二周期元素(除惰性气体外)的X的数值大小与原子半径之间的关系
。
(3)某化合物分子中含有S-N键,该共用电子对偏向于 原子(填元素符号)。
1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。臭氧分子的结构如图,呈V型,两个O-O键的夹角为116.5º,三个原子以一个O原子为中心,与另外两个氧原子分别构成共价键;中间O原子提供2个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学健―三个O原子均等地享有这4个电子。(如右图所示)。请回答:
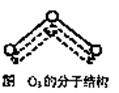
(1)臭氧与氧气的关系是______________。
(2)选出下列分子与O3分子的结构最相似的是( )
| A.H2O | B.CO2 | C.SO2 | D.BeCl2 |
(3)分子中某原子没有跟其他原子共用的价电子对叫孤对电子,那么O3分子有 对孤对电子。
(4)O3具有强氧化性,它能氧化PbS为PbSO4,而O2不能,试配平:
_____PbS + _____O3 ——_____PbSO4 + _____O2;
在下列物质中:①碘单质 ②烧碱晶体 ③N aCl晶体 ④干冰 ⑤固态氯化氢。用序号填写下列空白:
aCl晶体 ④干冰 ⑤固态氯化氢。用序号填写下列空白:
(1)既含有离子键又含有共价键的化合物是  。
。
(2)含有离子键的化合物是  。
。
(3)仅含有共价键的单质是  。
。
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E是同族元素,且D最外层电子数是次外层电子数的3倍。A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态。请回答下列问题(填空时用化学符号作答):
(1)BC-的电子式为 ;元素F在周期表中的位置为 。
(2)最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子。C4分子结构如右图所示。根据以上信息和数据,下列说法正确的是 。
A.C4属于一种新型的化合物 B.C4与C2互为同素异形体
C.C4稳定性比P4(白磷)差 D.C4与C2互为同位素
(3)A与C两种元素可形成多种化合物分子,其中CA3分子的分子的空间构型为
,键角 ;C2A4分子的结构式为 。
(4)为了除去化合物A2ED4稀溶液中混有的A2ED3,常采用A2D2为氧化剂,发生反应的离子方程式为 。
(5)E与F形成的化合物E2F2在橡胶工业上有重要用途,遇水易水解,其空间结构与A2D2极为相似。对此以下说法正确的是
A.E2F2的结构式为:F-E—E-F B.E2F2在一定条件下,有氧化性或还原性
C.E2F2中的两各E原子的化合价分别为0价和+2价
D.E2F2与H2O反应的化学方程式可能为:2E2F2+2H2O=EO2↑+ 3E↓+4HF
(6)B与D可形成两种常见化合物,其中一种化合物BD2是 分子(填“极性”或“非极性”)。在1000 mL 0.1 mol/L的 Ca(OH)2物质的水溶液中逐渐通入BD2并充分搅拌,溶液中析出沉淀的质量发生变化,在右图中画出沉淀质量随通入BD2的物质的量的变化曲线。
 |
X、Y、Z、W、Q是原子序数依次增大的短周期主族元素,X、W在周期表中的相对位置如下表;X元素最低负化合价的绝对值与其原子最外层电子数相等;Z是地壳中含量最多的金属元素。
(1)元素Q在周期表中位于第_____族,Z的离子结构示意图为_____。
(2)Z、W、Q的原子半径由大到小的顺序为 。(用元素符号表示其原子)。
(3)X和氢组成的化合物分子中有6个原子,其结构简式为______,写出该物质与水加成的化学方程式 。
(4)Y的最简单气态氢化物甲的水溶液显碱性
①用电离方程式表示氢化物甲的水溶液中的显碱性的原因 ,
②在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为____ __。该反应的氧化剂是 当有1mol甲参加反应时,电子转移 mol。
③Y的最简单气态氢化物甲和Q的氢化物乙反应生成正盐的电子式 ,
该化合物中所含化学键类型是 ,该化合物属于 晶体。
(1)用电子式写出MgCl2的形成过程: 。
(2)甲基(—CH3)的电子式为
(3)1~20号元素中,元素X的最高价氧化物对应的水化物的化学式为H2XOm,其气态氢化物的化学式为Hm/2X,则X的元素符号 。
(4)X、Y、Z、W是常见的短周期元素,其原子序数依次增大,且原子核外最外层电子数均不少于2。则:X一定不是 (填序号)
| A.氢 | B.碳 | C.氧 | D.硫 |
(6分)、下列五种物质中,①Ar ②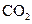 ③
③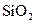 ④NaOH ⑤
④NaOH ⑤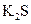 ,只存在共价键的是 ,只存在离子键的是 ,既存在离子键又存在共价键的是 ,不存在化学键的是 。属于共价化合物的是 属于离子化合物的是 。(填序号)
,只存在共价键的是 ,只存在离子键的是 ,既存在离子键又存在共价键的是 ,不存在化学键的是 。属于共价化合物的是 属于离子化合物的是 。(填序号)
判断物质中化学键时应该注意一些问题,下列说法中正确的是
①存在离子键的化合物一定是离子化合物,离子化合物中一定存在离子键
②离子化合物可以只含非金属元素,也可以存在共价键,如NH4Cl
③共价化合物中只含有共价键,不含离子键
④非金属单质(稀有气体除外)中只含有共价键
⑤稀有气体由单原子组成,无化学键
⑥只含有共价键的化合物一定是共价化合物,只含有共价键的物质不一定是共价化合物,可能是单质;含有共价键的化合物不一定是共价化合物,可能是离子化合物,例如NaOH
短周期元素A、B、C、D、E原子序数依次递增,A原子最外层电子数是次外层电子数的2倍,B的单质为双原子分子,其氢化物能使湿 润的石蕊试纸变蓝,C在同周期元素中原子半径最大,D的最外层电子数等于电子层数,E的最高正价是+7价。
润的石蕊试纸变蓝,C在同周期元素中原子半径最大,D的最外层电子数等于电子层数,E的最高正价是+7价。
(1)写出E元素在周期表中的位置
(2)写出A元素气态氢化物的结构式 
(3)B的氢化物和E的氢化物反应所得生成物的电子式为 。
(4)D单质和C的最高价氧化物对应的水化物的溶液反应的离子方程式为
(5)A单质与B的最高价氧化物对应的水化物的浓溶液反应的化学方程式为 。
回答下列问题
(1)画出磷原子的原子结构示意图: 。
(2)写出H2S分子的电子式: 。
(3)写出表示含有8个质子,10个中子的原子的化学符号: 。
。
(4)已知阴离子aXm—和阳离子bYn+具有相同的核外电子排布,则a、b、m、n之间的关系为a = 。
(5)用电子式表示氯化镁的形成过程:  。
。
(6)写出Na2O2中所含化学键的类型 。
(7)拆开1mol H—H键,1mol N—H键,1mol 键分别需要吸收的能量为436kJ ,391kJ,946kJ:
键分别需要吸收的能量为436kJ ,391kJ,946kJ:
则1mol N2完全转化成NH3 热量(填“吸收”或“放出”) kJ;
(8)利用下列反应:Fe + Cu2+ = Fe 2+ + Cu 制一个化学电池,写出电极反应式:
负极: ;正极 。
试题篮
()