(6分)开发新型储氢材料是氢能利用的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有______个。
②LiBH4由Li+和BH4-构成,BH4-呈正四面体构型。LiBH4中不存在的作用力有______(填标号)。
A.离子键 B.共价键 C.金属键 D.配位键
③Li、B、H元素的电负性由大到小排列顺序为______。
(2) 金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+______H-(填“>”、“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
M是______(填元素符号)。
(3)某种新型储氧材料的理论结构模型如下图所示,图中虚线框内碳原子的杂化轨道类型有______种。
用化学用语回答下列问题
(1)用电子式表示: Na2O2 ;
(2)用电子式表示Na2S的形成过程:
(3)用原子符号表示中子数为18的硫离子:
(4)空气中含量最多的气体单质分子的结构式 .
(5)氯化铵、次氯酸钠中均含有的化学键是
(6)原子序数为15的原子结构示意图: 、其最高价氧化物对应的水化物的化学式 、其气态氢化物的分子空间构型为 。
有:①11H、21H、31H ②H2、D2、T2③石墨、金刚石④正丁烷和异丁烷四组微粒或物质,回答下列问题:(填序号)
(1)互为同素异形体的是_______;(2)互为同分异构体的是__________
下列七种物质中 Ne O2 H2O NH3 H2SO4 KOH MgCl2
只含有共价键的是 ,只含有离子键的是 ,既含有离子键又含有共价键的
是 属于共价化合物的是 ,属于电解质的是 。(填化学式)
在HF、H2S、PCl3、CS2、CF4、N2分子中:
(1)以非极性键结合的非极性分子是________。
(2)以极性键相结合,具有直线形结构的非极性分子是________。
(3)以极性键相结合,具有三角锥形结构的极性分子是________。
(4)以极性键相结合,具有正四面体结构的非极性分子是________。
(5)以极性键相结合,具有V形结构的极性分子是________。
(6)以极性键相结合,而且分子极性最大的是________。
有下列几种物质:①HCl、②NH4Cl、③NaOH、④Cl2、⑤CO2、⑥H2O、⑦Na2O2。
(1)上述物质中,属于共价化合物的是 (填序号,下同),既存在离子键又存在极性键的是
(2)④号物质的电子式为 。
用电子式表示⑥号物质的形成过程:
(1)在下列变化中①I2升华,②烧碱熔化,③二氧化硅熔化,④NaCl溶于水,⑤H3PO4熔融,⑥O2溶于水,⑦Na2O2溶于水,⑧NaHSO4溶于水。未破坏化学键的是 ;仅离子键被破坏的是 ;仅共价键被破坏的是 ;离子键和共价键都被破坏的是 。
(2)判断:①SiC,②CO2,③Br2,④KCl晶体的熔点由高到低排列的顺序: (序号)
砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)基态砷原子的电子排布式为 ;砷与溴的第一电离能较大的是 。
(2)AsH3是无色稍有大蒜味气体。AsH3的沸点高于PH3,其主要原因是 。
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为 ,与其互为等电子体的一种分子为 。
(4)某砷的氧化物俗称“砒霜”,其分子结构如图所示。该化合物的分子式为 ,As原子采取 杂化。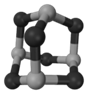
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与 个Ga相连,As与Ga之间存在的化学键有 (填字母)。
| A.离子键 | B.氢键 | C.配位键 | D.金属键 E.极性键 |
氮是地球上极为丰富的元素。
(1)N2是大气的主要成分之一,由于分子中键能很大,所以性质稳定。已知N≡N的键能为946 kJ·mol-1,N—N单键的键能为193 kJ·mol-1。
计算:N2分子中“π”键的键能约为 ;
结论:N2分子中“σ”和“π”键的稳定性 。
(2)氮的氧化物是大气污染物之一。为了消除污染,科研人员设计了同时消除二氧化硫和氮的氧化物的方法,其工艺流程如下: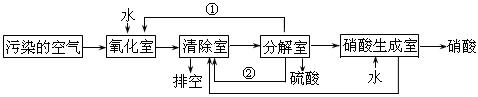
其中清除室、分解室发生的反应如下:
清除室:NO + NO2 = N2O3 N2O3 + 2H2SO4 = 2NOHSO4 + H2O
分解室:4NOHSO4 + O2 + 2H2O = 4H2SO4 + 4NO2
回答下列问题:
Ⅰ.①和②分别为(写化学式) 、 ;
Ⅱ.氧化室发生的反应是 ;
(3)金属氮化物是一类重要的化学物质,有着特殊的用途。某金属离子(M+)与N3—形成的晶体结构如右图所示。其 中M+中所有电子正好充满K、L、M三个电子层,它M+的符号是 ,与同一个N3-相连的M+有 个。
中M+中所有电子正好充满K、L、M三个电子层,它M+的符号是 ,与同一个N3-相连的M+有 个。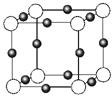
(4)NH3既是重要的工业产品,又是主要的工业原料。以NH3为原料生产硝酸铵的过
程如下: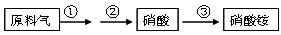
其中反应②为:4NO+3O2+2H2O=4HNO3 原料气为氨气和空气的混合物,假设空气中氧气的体积分数为0.2。
Ⅰ.写出反应①的化学方程式 。若不考虑副反应且各步反应均完全,生产过程中原料气中的氨气(不包含第③步被硝酸吸收的氨气)和空气中氧气恰好全部转化为硝酸,则原料气中制备硝酸的氨气和氧气的体积比为 。
Ⅱ.若实际生产中,反应①中氨的转化率(或利用率)为70%,反应②中NO的转化率为90%,反应③中氨和硝酸均完全转化。则生产硝酸的氨气占所用氨气总量的体积分数为多少?(写出计算过程)
试题篮
()