下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
(1)已知由①、③、④三种元素组成的某种常见化合物的水溶液呈酸性,则符合该条件的化合物的化学式可能为(至少写两种)。
(2)由表中①、④两种元素按原子个数比为1∶1构成的化合物的稀溶液易被催化分解,通常使用的催化剂为(填序号)。
a、MnO2 b、FeCl3 c、Na2SO3 d、KMnO4
(3)下图中A~F是由部分上表中元素组成的单质或化合物,其中A、B、C为单质,转化关系如下:
Ⅰ.若B为黄色固体,A为原子半径最小的原子组成的单质。
①F的电子式为。
②实验测得起始参加反应的B和最后生成的B质量相等,则起始参加反应的A和C的物质的量之比是。
Ⅱ.若D为淡黄色固体,焰色反应为黄色,组成C的元素的原子最外层电子数是内层电子数的2倍。
①下列关于D的说法正确的是(填字母)。
a.能与水发生化合反应
b.既有氧化性,又有还原性
c.既含离子键,又含非极性共价键
d.是一种碱性氧化物
②用惰性电极将F的饱和溶液进行电解,则阳极反应式是。
氯元素是生产生活中常见的非金属元素。
(1)将Cl2通入NaOH溶液中得到以NaClO为有效成分的漂白液,写出该反应的离子方程式:;不直接用Cl2作漂白剂的原因是(写出两条)。
(2)使用Cl2为自来水消毒时,会与水中的有机物生成对人体有害的有机氯化物。下列物质中可以替代Cl2为自来水杀菌消毒的是(填字母序号)。
a.臭氧b.NH3 c.明矾 d.ClO2
(3)生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中氯含量较多,燃烧过程中会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀。
①NaCl和Cl2中化学键的类型分别是和。
②燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2。若生成Cl2 22.4 L(标况)时转移电子数为4×6.02×1023,该反应的化学方程式是。
③已知:
2H2O2(l) ===2H2O(l)+O2(g)ΔH1 =-196.46 kJ·mol-1
H2(g)+ O2(g) ="==" H2O(l)ΔH2 =-285.84 kJ·mol-1
O2(g) ="==" H2O(l)ΔH2 =-285.84 kJ·mol-1
Cl2(g)+H2(g) ="==" 2HCl(g)ΔH3 =-184.60 kJ·mol-1
在催化剂作用下,用H2O2(l)可除去上述燃烧过程中产生的Cl2。依据上述已知反应,写出该反应的热化学方程式:。
短周期元素A、X、D、E、R、T原子序数依次增大,原子结构及性质如表所示:
| 元素 |
结构及性质 |
| A |
A的原子半径最小 |
| X |
X原子最外层电子数是次外层的两倍 |
| D |
D是短周期中金属性最强的元素 |
| E |
E的最高价氧化物对应水化物是一种常见的两性氢氧化物 |
| R |
R与X同主族 |
| T |
T的负一价阴离子的核外电子排布与Ar原子相同 |
(1)R元素在周期表的位置是,化合物DT中存在的化学键是。
(2)写出E单质与NaOH溶液反应的离子方程式。
(3)1g X2A4 完全燃烧,恢复到常温时放出a kJ的热量,写出X2A4完全燃烧的热化学方程式。
(4)RT4极易水解生成两种酸,写出该反应的化学方程式。
(5)已知某温度下T的某一元含氧酸的Ka = 4.0×10-8,若一定浓度该酸的pH=4,则此溶液的物质的量浓度为。
下表是元素周期表的一部分,根据要求回答下列问题。
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
O |
| 2 |
E |
H |
F |
I |
||||
| 3 |
A |
C |
D |
G |
R |
|||
| 4 |
B |
(1)十种元素中化学性质最不活泼的元素是________(填元素符号)。
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是________(填化学式)。
(3)I元素跟A元素形成化合物的电子式是_____。并用电子式表示该化合物的形成过程___。
(4)G的单质和B的最高价氧化物对应水化物反应的离子方程式是__________________。
(5)元素A和F能形成两种化合物,写出其中较稳定的化合物与CO2反应生成氧气的化学方程式 ____。
W、X、Y、Z是元素周期表中原子前四周期的四种元素,有关它们的信息如下表所示。
| 元素 |
相关信息 |
| W |
W的基态原子L层电子数是K层电子数的3倍 |
| X |
X与氢元素形成的一种化合物可以使湿润的红色石蕊试纸变蓝 |
| Y |
单质为黄绿色气体,最高价氧化物对应的水化物化学式为HYO4 |
| Z |
Z的基态原子外围电子排布式为(n-1)d10ns1 |
(1)Y位于元素周期表第________周期第________族;X的基态原子核外电子排布式是。
(2)W的简单离子半径X的简单离子半径(填“>”、“<”或“=”);Y的第一电离能比Z的(填“大”或“小”);W、X的最简单气态氢化物中,沸点较高的是(填化学式)。
(3)在150℃左右时,化合物ZW与氢气反应生成红色的Z2W粉末,该反应的化学方程式为。
(4)W元素形成的多种化合物分子中,含有极性共价键和非极性共价键的分子名称为
(任写一种)。
(5)在25℃、101 kPa下,已知Z固体单质在Y2气体中完全燃烧后恢复至原状态,平均每转移1mol 电子放热110.05kJ,该反应的热化学方程式是。
元素周期表的形式多种多样,下图是扇形元素周期表的一部分,对照中学化学常见长式元素周期表,回答下列问题:
(1)元素C的最高价氧化物的电子式为;元素G的离子结构示意图为。
(2)元素L位于周期表的第族,1mol/L LM2溶液500ml与0.4 mol K单质恰好完全反应的离子方程式为_______________________________________。
(3)化合物X是由B、E、G三种元素组成,其水溶液呈_____性,原因是____________(用离子方程式表示)。
(4)D和G组成的化合物GD,被大量用于制造电子元件。工业上用G的氧化物、C单质和D单质在高温下制备GD,其中G的氧化物和C单质的物质的量之比为1:3,则该反应的化学方程式为。
(5)制取粗硅的过程中,SiO是反应中间产物,隔绝空气时SiO和NaOH溶液反应(产物之一是硅酸钠)的化学方程式______________________________________________。
X、Y、Z、W为四种短周期元素。X原子最外层电子数是核外电子层数的3倍;Y最高正价与最低负价的代数和为6;Z在地壳中的含量仅次于氧;Y、Z、W同周期,W的常见化合价为+3。回答下列问题:
(1)Y-的结构示意图为。
(2)写出含有10个中子的X原子的原子符号。
(3)Z的最高价氧化物与Z同主族的单质A能发生置换反应,这个反应在工业上是获得Z的一步重要反应。写出该步反应的化学方程式,并用单线桥法标出电子转移的方向与数目。
(4)向WY3溶液中加入足量的NaOH溶液,反应的离子方程式为。
(5)Y的气态氢化物与氨气在空气中相遇有白烟生成,该反应的化学方程式为。
(6)ZX2中存在的化学键为(填“离子键”或“共价键”),ZX2与NaOH溶液反应的化学方程式为。
[化学——选修3:物质结构与性质]
碳及其化合物广泛存在于自然界中。回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用 形象化描述。在基态14C原子中,核外存在_______________对自旋相反的电子;
(2)碳在形成化合物时,其键型以共价键为主,原因是 。
(3)CS2分子中,共价键的类型有 、C原子的杂化轨道类型是 ,写出两个与CS2具有相同空间构型和键合形式的分子或离子 。
(4)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253 K,沸点为376 K,其固体属于 晶体。
(5)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
①在石墨烯晶体中,每个C原子连接 个六元环,每个六元环占有 个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接 个六元环,六元环中最多有 个C原子在同一平面。

乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2中C2- 2与O2+ 2、N2互为等电子体,O2+ 2的电子式可表示为 ;1mol O2+ 2中含有的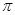 键为 mol。
键为 mol。
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为 。
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是 、 。
(4)CaC2晶体的晶胞结构与NaCl晶体的相似(如右图所示),但CaC2晶体中有哑铃形的C2- 2存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离相等且最近的C2- 2数目为 。
氮元素可以形成多种分子和离子,如NH3、N2H4、N2-、NH4+、N2H62+等。回答以下问题:
(1)N的基态原子中,有_________个运动状态不同的未成对电子;
(2)某元素原子与N3-含有相同的电子数,其基态原子的价电子排布图是____________;
(3)NH3、N2H4、NH4+、N2H62+四种微粒中,同种微粒间能形成氢键的有_________;不能作为配位体的有_______;
(4)纯叠氮酸HN3在常温下是一种液体,沸点较高,为308.8K,主要原因是_______;
(5)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.
①N2H4分子中氮原子的杂化类型是_________;
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g)
若该反应中有4mol N-H键断裂,则形成的π键有_________mol;
(6)肼能与硫酸反应生成N2H6SO4.N2H6SO4化合物类型与硫酸铵相同,则N2H6SO4内微粒间作用力不存在_________(填标号)
a.离子键 b.共价键 c.配位键 d.范德华力
据2014年1月17日网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构,是一种高能量分子。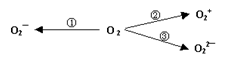
(1)下列有关O4的说法正确的是:
| A.O4分子内存在极性共价键 |
| B.合成O4的反应可看作核聚变反应,即不属于化学变化 |
| C.O4与O3、O2都是氧的同素异形体 |
| D.O4不可用作氧化剂 |
(2)制备含O2-、O22-甚至O2+的化合物都是可能的,通常它们是在氧分子进行下列各种反应时生成的:上述反应中, (填序号)相当于氧分子的氧化; (填序号)相当于氧分子的还原。
(3)写出O22—的电子式:
(4)O2[PtF6]是一种含有O2+的化合物,请写出一种含有O2-的氧化物的化学式:______________。
W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物之间可以反应生盐和水,该反应的离子方程式为__________________________
(2)W与Y可形成化合物W2Y,该化合物的电子式为_________。
(3)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是(用离子符号表示):_________>_________>_________>_________。
(4)Z的最高价氧化物与水反应得到一种稀溶液,写出该反应的离子方程式_________________________
下表是元素周期表中的一部分,根据A~I在元素周期表中的位置,用元素符号或化学式回答下列问题:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
A |
|||||||
| 2 |
D |
E |
G |
I |
||||
| 3 |
B |
C |
F |
H |
(1)上表中,化学性质最不活泼的元素是_____,氧化性最强的单质是_____,还原性最强的是_____。
(2)最高价氧化物对应水化物的碱性最强的元素是________,酸性最强的元素是________。
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的是___________。
(4)请用电子式表示化合物BG的形成过程________________。
(5)写出C的最高价氧化物对应水化物与B的最高价氧化物对应水化物反应的离子方程式:______________。
有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素.已知A、C及B、E分别是同主族元素,且B、E两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍.处于同周期的C、D、E元素中,D是该周期金属元素中金属性最弱的元素.
(1)试比较C、D两元素最高价氧化物对应水化物碱性的强弱(填化学式)
>;
(2)A、B、C形成的化合物的晶体类型为;电子式为;
(3)写出D单质与C元素最高价氧化物对应水化物反应的离子方程式;
(4)写出两种均含A、B、C、E四种元素的化合物在溶液中相互反应、且生成气体的离子方程式;
(5)A单质和B单质能构成电池,该电池用多孔惰性电极浸入浓KOH溶液,两极分别通入A单质和B单质,写出该电池负极电极反应方程式;
(6)通常条件下, C的最高价氧化物对应水化物2mol与E最高价氧化物对应水化物1mol的稀溶液间反应放出的热量为114.6KJ,试写出表示该热量变化的离子方程式.
短周期元素X、Y、Z、L、M、Q的原子半径和主要化合价见下表
| 元素代号 |
X |
Y |
Z |
L |
M |
Q |
| 原子半径/nm |
0.160 |
0.143 |
0.102 |
0.099 |
0.077 |
0.074 |
| 主要化合价 |
+2 |
+3 |
+6、-2 |
+7、-1 |
+4、-4 |
-2 |
就以上6种元素,用化学用语回答下列问题
(1)同主族的元素是 ,
(2)写出同周期元素间形成的常温下是有毒气体化合物的分子式为 ,
(3)写出不同周期的元素间形成的常温下为液体且难溶于水的任意一种化合物的电子式。
(4)等质量的X、Y的单质与足量盐酸反应,生成H2的物质的量之比为
(5)写出由表中元素形成的物质间发生常见的置换反应的化学方程式
试题篮
()